25.10.22 г. ВТОРНИК. Гр.306,405,308
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи (ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать!) После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)
Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы.
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 306 БИОЛОГИЯ 7,8
ТЕМА 7:
Универсальным источником энергии во всех клетках служит


Нуклеотиды могут также принимать участие в регуляции окислительных процессов в клетке.
Витамины принимают участие в обмене веществ преимущественно как составная часть сложных ферментов. Их отсутствие или недостаток приводит к тяжёлым нарушениям жизнедеятельности организма.
ТЕМА 8:Клетка – элементарная единица живого.
Клетка - элементарная единица структурной организации живой материи
Клетка — элементарная единица структуры, функции и развития живой материи, которая характеризуется подразделением на ядро (или нуклеоид), цитоплазму и клеточную мембрану и обладает всем комплексом свойств живого: самовоспроизведением, саморазвитием, ростом, саморегуляцией, обменом веществ и энергии, раздражимостью, подвижностью, адаптацией и способностью противостоять энтропии.
В состав многоклеточных организмов наряду с клетками входят симпласты, синцитии1 и межклеточное вещество. Однако ведущей формой структурной организации организмов, безусловно, является клетка, поскольку все перечисленные выше формы являются либо производными клетки (клеток), либо образуются в результате ее синтетической деятельности.
Все клеточные формы органического мира, как указывалось выше, подразделяются на прокариот и эукариот; их сравнительная характеристика представлена в табл. 3.1 и на рис. 3.1.
Таблица 3.1
Сравнительная характеристика прокариот и эукариот
Признаки и свойства | Прокариоты | Эукариоты |
Морфологически оформленное ядро | Отсутствует | Имеется |
Нуклеоид* | И меется | Отсутствует |
Форма молекулы ДНК | Кольцевая | Линейная |
Длина ДНК | 1 (условно) | 1000 (по отношению к прокариотам) |
Ядерные белки, связанные с ДНК | Отсутствуют | Имеются |
CRISPR-систсма в геноме** | Имеется | Отсутствует |
Плоидность генома | Гаплоидный | Диплоидный*** |
Фенотипические проявления мутаций | Каждая мутация реализуется в фенотипе | Возможно сохранение мутантного рецессивного гена в гетерозиготном состоянии |
Микротрубочки и состоящие из них структуры (цеитриоли и др.) | Отсутствуют | Имеются |
Деление митозом | Не характерно**** | Характерно |
Клеточная оболочка | Плазмалемма + клеточная стенка (из пептидоглика- нов) | Плазмалемма (+ клеточная стенка из целлюлозы у растений и хитина — у грибов) |
Сократительные белки (актин и миозин) | Отсутствуют | Имеются |
1 Симпласты и синцитии состоят из единой цитоплазмы с множеством ядер и покрыты клеточной мембраной. Симпласты образуются в результате слияния нескольких клеток (скелетное мышечное волокно), синцитии — в результате многократного митотического деления ядра без последующего разделения клеточного тела (часть сперматогенного эпителия).
Признаки и свойства | Прокариоты | Эукариоты |
Жгутики | Пить жгутика построена из субъединиц белка , образующих спираль | Каждый жгутик содержит набор микротрубочек, собранных в группы |
Способ питания | Голофитный (всасывание растворенных веществ; не способны к образованию псевдоподий) | Голозойный (захват твердых частиц) |
Система внутриклеточных мембран | Отсутствует (внутриклеточные потоки не упорядочены) | Имеется (внутриклеточные потоки упорядочены) |
Рибосомы | Имеются, масса небольшая | Имеются |
Митохондрии и хлоропласты | Отсутствуют | Имеются |
Локализация биоэнергетических структур | Клеточная оболочка | Митохондрии |
Эволюционные перспективы | Адаптивная эволюция (структурные перестройки невозможны) | 11рогрессивная (возможны глубокие структурные преобразования) |
* Находящаяся в центре прокариотической клетки структура, имеющая форму ромашки (центральная часть — остов — образован РНК, «лепестки» — около 50 петель ДНК).
** Особая генетическая конструкция, обеспечивающая иммунную защиту бактерий от вирусов и играющая определенную роль в рекомбинации и репарации ДНК.
*** За исключением половых клеток и соматических клеток некоторых водорослей, грибов, растений (мхов).
**** Прокариотические клетки размножаются простым поперечным делением.

Рис. 3.1. Общая схема строения прокариотической (я) и эукариотической (6) клеток:
1 — плазматическая мембрана; 2 — клеточная стенка; 3 — жгутик; 4 — нуклеоид; 5 — рибосомы; 6 — ядро; 7 — мембранные органеллы
Эукариоты в эволюционном плане оказались более перспективными по сравнению с прокариотами, так как:
- • содержали больший объем генетической информации (двойной набор генов, множество копий отдельных генов);
- • имели возможность накапливать в популяциях особей рецессивные мутантные гены в гетерозиготном состоянии и тем самым формировать резерв наследственной изменчивости (важное условие для эффективного протекания естественного отбора);
- • могли осуществлять более тонкую и сложную регуляцию жизнедеятельности клеток (множество регуляторных генов, возможность использовать геном по частям);
- • имели более совершенную пространственно-временную организацию метаболизма (благодаря компартментации внутреннего объема клетки, т.е. разделения пространства клетки мембранами на отсеки);
- • обладали более пластичной клеточной оболочкой, способной к образованию разнообразных межклеточных соединений с различными функциями (контактов);
- • имели высокосовершенный механизм воспроизведения генетически идентичных клеток (митоз), на базе которого при дальнейшей эволюции многоклеточных форм возник мейоз;
- • обладали более эффективным механизмом извлечения и аккумулирования энергии (дыхание).
ГРУППА 405 химия 23,24
| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
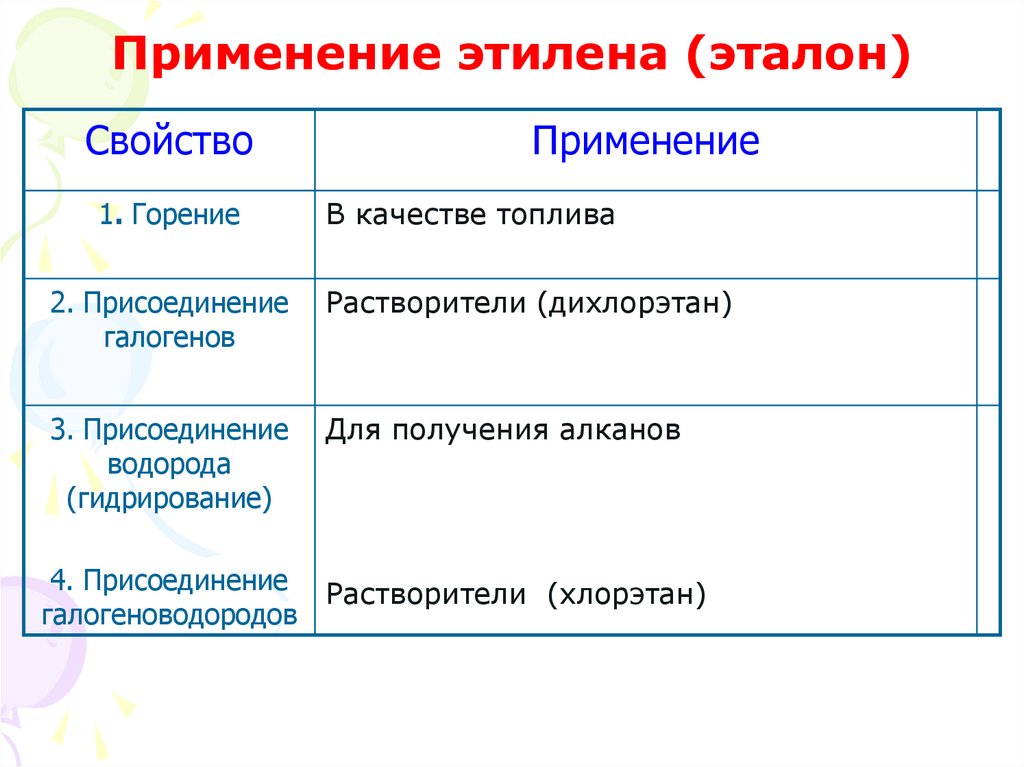
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 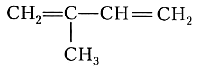
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 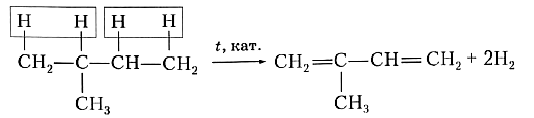
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 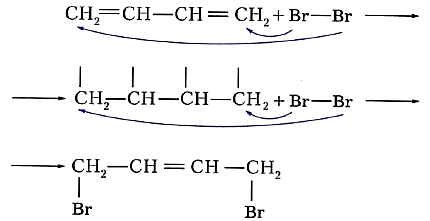
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 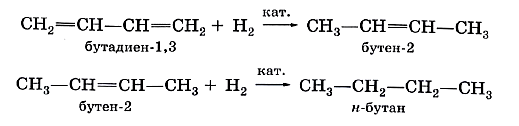
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 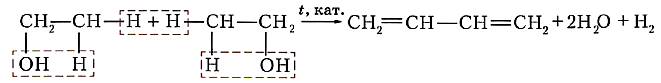
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
Металлы побочных подгрупп (Б-групп) периодической системы химических элементов.
ВНИМАТЕЛЬНО ПОСМОТРИТЕ ВИДЕОИ ВЫПОЛНИТЕ НЕОБХОДИМЫЕ ЗАПИСИ.
К металлам относятся все элементы побочных (Б) подгрупп, а также элементы главных подгрупп, расположенные ниже диагонали «бериллий – астат» (Рис. 1). Кроме того, химические элементы металлы образуют группы лантаноидов и актиноидов. Рис. 1. Расположение металлов среди элементов подгрупп А (выделены синим).
Металлы главных подгрупп
К изучаемым в школьном курсе металлам главных подгрупп I-III группы относятся литий Li,натрий Na, калий K, рубидий Rb, цезий Cs, магний Mg, кальций Ca, стронций Sr, барий Ba, алюминий Al
В настоящее время известно
Некоторые металлы, такие как золото, серебро, ртуть, медь, олово, железо, свинец известны человечеству с глубокой древности. Алхимики связывали их с планетами и соответствующим образом обозначали: золото — Солнце, серебро — Луна, ртуть — Меркурий, медь — Венера, олово — Юпитер, свинец — Сатурн.

Рис. 1. Обозначение химических элементов в алхимии
У атомов наиболее типичных металлов, к которым относятся щелочные и щёлочноземельные, а также у переходных металлов на внешнем уровне содержится
Металлические свойства обусловлены способностью атомов отдавать электроны внешнего уровня. С ростом заряда ядра атома металлические свойства ослабевают слева направо по периоду и возрастают сверху вниз по подгруппе.
Отдавая электроны внешнего уровня, атомы металлов образуют устойчивую оболочку ближайшего благородного газа и приобретают положительную степень окисления.
химические элементы, атомы которых легко отдают электроны внешнего электронного слоя, превращаясь в положительные ионы.
Принципиальное отличие простых веществ металлов от простых веществ неметаллов заключается в том, что в химических реакциях металлы являются только восстановителями.
Наиболее распространённым в земной коре металлом является алюминий (
Для простых веществ металлов характерна металлическая кристаллическая решётка. В узлах металлической решётки находятся катионы металла, между которыми перемещаются электроны, образуя так называемый «электронный газ». «Электронный газ» движется между узлами решётки, обеспечивая её устойчивость. Металлическая решётка характерна для металлов и их сплавов. Свободно перемещающиеся электроны обусловливают характерные свойства веществ с металлической решёткой.

Рис. 2. Металлическая кристаллическая решётка
Металлическая связь и строение кристаллических решеток металлов обусловливают все важнейшие характерные физические свойства металлов, а именно: электропроводность, теплопроводность, пластичность, металлический блеск.
Электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля. Наиболее электропроводными металлами являются серебро и медь, наименее — ртуть.
Теплопроводность металлов также связана с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решетки ионами, электроны обмениваются с ними энергией.
Пластичность – свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия. Пластичность металлов обусловлена способностью их атомов под внешним воздействием смещаться друг относительно друга, но не рассыпаться за счёт прочного удерживания атомов общим электронным облаком. Наиболее пластичны золото, серебро, медь, олово. Так, золото легко прокатывают в тонкую фольгу, получая так называемое сусальное золото, которое используется в декоративных целях для золочения различных изделий.
Металлический блеск металлов обусловлен их способностью отражать световые лучи.
Такие свойства металлов, как твёрдость, плотность, температура плавления изменяются в широких пределах.
Наибольшей твёрдостью обладают металлы побочной подгруппы
Металлы с плотностью меньше

Рис. 3. Плотность некоторых металлов
При обычных условиях все металлы, кроме ртути имеют твёрдое агрегатное состояние. Ртуть — единственный жидкий металл. К легкоплавким металлам относятся цезий и галлий, они могут плавиться на ладони руки. Самый тугоплавкий металл — вольфрам.

Рис. 4. Температура плавления некоторых металлов
Металлы делят на чёрные, к которым относятся железо и его сплавы, и цветные — все остальные. Однако для большинства металлов характерен белый или серый цвет. Золото окрашено в жёлтый цвет, а медь — в красный. Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам.
 Коротко о главном
Коротко о главном
Наиболее распространённым в земной коре металлом является алюминий.
Металлы — химические элементы, атомы которых легко отдают электроны внешнего электронного слоя, превращаясь в положительные ионы.
Атомы большинства металлов содержат на внешнем уровне содержится
В химических реакциях металлы являются только восстановителями.
Важнейшими характерными физическими свойствами металлов являются высокие электро- и теплопроводность, пластичность, металлический блеск. Общие свойства металлов обусловлены металлической связью и строением их кристаллических решёток.
Такие свойства металлов, как твёрдость, плотность, температура плавления изменяются в широких пределах.
 Вопросы для самоконтроля
Вопросы для самоконтроля
- Сравните строение атомов металлов и неметаллов.
- Поясните, почему атомы металлов способны проявлять только восстановительные свойства
- Как изменяются металлические свойства в периодах и главных подгруппах с ростом заряда ядра атома?
- Какой тип кристаллической решетки характерен для металлов? Как свойства металлов связаны с особенностями их кристаллической решётки?
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа;
щелочноземельные металлы – II(A) группа, кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O2 =обыч. усл.= 2Li2O
2Mg + O2 =t, °C= 2MgO
Серебро, золото и платина с кислородом не реагируют
Au + O2 ≠
Видео «Горение магния на воздухе»
Видео "Самовоспламенение никеля на воздухе"
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме+nГ-1n
2Na + Cl2 = 2NaCl
2Al + 3Cl2 = 2AlCl3
3. Металлы взаимодействуют с серой, образуя сульфиды.
Zn + S = ZnS
Видео «Взаимодействие цинка с серой»
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Ca + N2 =t, °C= Ca3N2
3Na + P =t, °C= Na3P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий. В результате образуются основание и газ водород.
Me + H2O = Me(OH)n + H2 (р. замещения)
Видео «Взаимодействие натрия с водой»
Внимание! Алюминий и магний ведут себя также:
2Al + 6H2O = 2Al(OH)3+3H2
Магний (в горячей воде):
Mg + 2H2O =t°C= Mg(OH)2+H2
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н2) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н2О = МехОу + Н2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H2O =t°C= BeO + H2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород:
3Fe + 4H2O =t°C= FeO‧Fe2O3 + 4H2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H2O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот (раствор азотной кислоты – исключение), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Cu + H2SO4 ≠
Au + H2SO4 ≠
Видео «Электрохимический ряд напряжений - вытеснение водорода металлами»
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = Сульфат + H2O + Х
2H2SO4 (конц.) + Cu =t°C= CuSO4 + 2H2O + SO2↑
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2↑ + 4H2O
Повторите «Окислительные свойства концентрированной серной кислоты»
HNO3 + Me = Нитрат + H2O + Х
4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
4Zn + 10HNO3 (раствор горячий) =t˚C= 4Zn(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 (оч. разб. горячий) =t˚C= 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 4HNO3 (конц. горячий) =t˚C= Zn(NO3)2 + 2NO2 + 2H2O
Повторите «Специфические свойства азотной кислоты»
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
Видео «Электрохимический ряд напряжений металлов. Вытеснение металла из соли другими металлами»
Видео «Взаимодействие металлов с солями»
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Видео «Взаимодействие хлорида олова (II) с цинком («Оловянный ежик»)»