ПОНЕДЕЛЬНИК, 08.11.21г. 306, 308, 301
моя почта : rimma.lu@gmail.com
ГРУППА 306 ХИМИЯ 21,22
ТЕМЫ:
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование. Применение алканов на основе свойств. Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: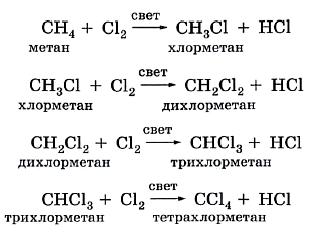
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.
Области применения алканов связаны с их физико-химическими свойствами:
Это интересно:
Таблица «Предельные углеводороды
(алканы, парафины)»

ГРУППА 308 ХИМИЯ 25,26 ТЕМА: Химические свойства глюкозы. Применение. I. Получение глюкозы 1. В промышленности
(C6H10O5)n + nH2O t,H+→ nC6H12O6 крахмал глюкоза 2. В лаборатории
6 HCOH Ca(OH)2→ C6H12O6 формальдегид 3. В природе
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2 4. Другие способы
C12H22O11 + H2O t,H+→ 2 C6H12O6 мальтоза глюкоза C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6 сахароза глюкоза фруктоза II. Химические свойства глюкозы 1. Специфические свойства Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов: 1.Спиртовое брожение: C6H12O6 → 2C2H5-OH + 2CO2↑ 2. Молочнокислое брожение:
3. Маслянокислое брожение: C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑ 2. Свойства альдегидов 1. Реакция серебряного зеркала: Видео-опыт: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)» СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓ или СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O СH2OH(CHOH)4-COOH - глюконовая кислота 2. Окисление гидроксидом меди (II): СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O голубой красный
Рис. 1 Cu2O↓ 3. Восстановление: СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH сорбит – шестиатомный спирт 3. Свойства многоатомных спиртов 1. Образование простых эфиров со спиртами При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
2. Качественная реакция многоатомных спиртов Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета. Видео-опыт: «Качественная реакция глюкозы с гидроксидом меди (II)» Рис. 2. Глюконат меди (II) 4. Реакции окисления Видео-опыт: “Окисление глюкозы кислородом воздуха в присутствии метиленового голубого” Видео-опыт: “Определение глюкозы в виноградном соке” Видео-опыт: “Распознавание глюкозы с помощью качественных реакций”
III. Применение Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению: C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива. IV. Тренажеры Тренажер №1: “Химические свойства глюкозы” ЦОРы Видео: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)» Видео: «Качественная реакция глюкозы с гидроксидом меди (II)» Видео: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого” Видео: “Определение глюкозы в виноградном соке” Видео: “Распознавание глюкозы с помощью качественных реакций” ТЕМА: Сахароза. Нахождение в природе. Свойства, применение Сахароза. Нахождение в природе. Свойства, применениеМолекулы углеводов моносахаридов способны взаимодействовать друг с другом, образуя цепи различной длины. На этом уроке мы рассмотрим, как это происходит и как образуются олиго- и полисахариды. Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар). Более подробно обсудим самый известный и наиболее распространенный дисахарид – о сахарозу. Рассмотрим гидролиз сахарозы. I. Фильм: “Углеводы: дисахариды”
II. Cтроение дисахаридов Олигосахариды – это продукты конденсации двух или нескольких молекул моносахаридов. Дисахариды – это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов. Молекулярная формула сахарозы – С12Н22О11 Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2)-гликозидной связью:
III. Физические свойства и нахождение в природе Cахароза представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде. Температура плавления сахарозы 160 °C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике. IV. Химические свойства 1. Качественная реакция (для многоатомных спиртов) Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов). Видео-опыт: «Доказательство наличия гидроксильных групп в сахарозе» 2. Свойства невосстанавливающего дисахарида При нагревании с гидроксидом меди (II) не образует красного оксида меди (I). Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию "серебряного зеркала", так как не способна превращаться в открытую форму, содержащую альдегидную группу. Подобные дисахариды не способны окисляться (т.е. быть восстановителями) и называются невосстанавливающими сахарами. Видео-опыт: «Отсутствие восстанавливающей способности сахарозы» 3. Реакция сахарозы с водой Важное химическое свойство сахарозы – способность подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы: С12Н22О11 + Н2О t, H2SO4→ С6Н12O6 + С6Н12O6 Видео-опыт: «Кислотный гидролиз сахарозы» Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу. При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов. V. Применение сахарозы
Фильм: “Углеводы: дисахариды” Видео-опыт: «Доказательство наличия гидроксильных групп в сахарозе» Видео-опыт: «Отсутствие восстанавливающей способности сахарозы» Видео-опыт: «Отсутствие восстанавливающей способности сахарозы» |
ТЕМА: Реакции присоединения (гидрирования, галогенирования, гидрогалогенирования, гидратации)
ТЕМА: Реакции отщепления (дегидрирования, дегидрогалогенирования, дегидратации)
Реакции присоединения (гидрирования, галогенирования, гидрогалогенирования, гидратации)
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
А + В→С
Примеры:
CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 бромирование пропена
CH2=CH2 + H2O→CH3CH2OH гидратация этилена
К реакциям присоединения относятся также реакции полимеризации:
n A → An
Например, образование полиэтилена: n CH2=CH2→(-CH2-CH2-) n
Реакции отщепления (дегидрирования, дегидрогалогенирования, дегидратации).
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
А→ В + С
Например:
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
CH3-CH2Cl →CH2=CH2 + HCl
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
CH3-CH3 →CH2=CH2 + H2 дегидрирование этана
.




