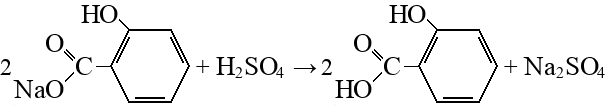Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ:
Ср. 10.05: 506,403,-, 508
Чт. 27.04: -,-,-, 508
ГРУППА 506 ХИМИЯ 37, 38
ТЕМА: Особенности взаимодействия концентрированной серной и азотной кислот с металлами. Основные способы получения кислоты.
Азотная кислота
Состав продуктов восстановления

Рис. 1. Зависимость продуктов восстановления
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = Сульфат + H2O + Х
2H2SO4 (конц.) + Cu =t°C= CuSO4 + 2H2O + SO2↑
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2↑ + 4H2O
Окислительные свойства концентрированной серной кислоты
Особые свойства концентрированной серной кислоты
1. С водой образуются гидраты:
H2SO4 + nH2O = H2SO4 · nH2O + Q
"Гигроскопичность серной кислоты"
2. Органические вещества обугливаются
C12H22O11 (сахароза) - H2SO4(конц., -11H2O → 12С (уголь)
3. Серная кислота окисляет неметаллы и металлами:
а) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
H2SO4 (конц.) + Me = соль + H2O + Х
, где Х – H2S, S, SO2
2Ag0 + 2H2+6SO4 = Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2 + 4H2O
б) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе
, где неметалл в высшей валентности
С0 + 2H2S+6O4(конц) = C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) = 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) = 5S+4O2 + 2H3P+5O4 + 2H2O
Тренажёр - Обобщающий тест "Элементы подгруппы кислорода и их соединения"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Запишите уравнения реакций между серной концентрированной кислотой и следующими веществами: натрия, ртуть, сера.
Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
№2. Вычислите объём газа (н.у.), который образуется при взаимодействии 15% - ного раствора серной кислоты массой 900 г с цинком?
№3. Осуществите превращения по схеме:
Сu → CuSO4 → Cu(OH)2 → CuO → CuSO4 → BaSO4
2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой:
ТЕМА:Основания и их свойства. Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований.
ПЛАН
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH-
Ca(OH)2 ® CaOH+ + OH- ® Ca2+ + 2OH- -
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
- В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН- в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH- + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH- + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH- + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов
Вариант 1
1. Одноосновная бескислородная кислота
А) H2S Б) H2CO3 В) HF Г) HNO3
2. Сумма коэффициентов в полном ионном уравнении BaCl2 + H2SO4=
А) 11 Б) 10 В) 7 Г) 9
3. Коэффициенты перед AlCL3 и NH4Cl в уравнении реакции NH4NO3 + AlCL3 = Al(NO3)3 + NH4Cl соответственно равны…
А) 1 и 2 Б) 1 и 3 В) 3 и 1 Г) 2 и 1
4. Элементы только побочных подгрупп находятся в ряду
А) Sc, Mo, W Б) Ta, Ca, Mn В) As, Br, Cr Г) Sb, Co, Ge
5. Металлические свойства убывают в ряду
А) Ge, Sn, Pb Б) Sr, Y, Mo В) Tc, Nb, Sr Г) K, Rb, Cs
6. Самый активный неметалл
А) At Б) F В) B Г) Si
7. Максимальная валентность атома Se равна
А) 2 Б) 4 В) 8 Г) 6
8. Относительная молекулярная масса K2S
А) 71 Б) 110 ат. ед. м. В) 110 Г) 71 ат. ед. м.
9. Электронное строение атома калия соответствует выражению
А) 1S22S22P63S23P64S1 Б) 1S22S22P63S23P63d1
В) 1S22S22P63S23P7 Г) 1S22S22P63S23P64S2
10. Количество элементов в 5 периоде
А) 18 Б) 32 В) 8 Г) 24
11. Максимальное число электронов на р-орбиталях:
А) 2; Б) 6; В) 10; Г) 14.
12. Число нейтронов в атоме цинка равно:
А) 65; Б) 22; В) 30; Г) 35.
13. В периоде слева направо уменьшается
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
14. Степень окисления атома углерода в соединении Ca(ClO2)2 равна
А ) -4 Б) -3 В) +4 Г) +3
15. Сумма коэффициентов в полном ионном уравнении реакции взаимодействия хлорида кальция и нитрата серебра
А) 10 Б) 8 В) 14 Г) 12
16. Сокращённое ионное уравнение: Fe2+ + 2OH- = Fe (OH)2 соответствует взаимодействию
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
17. Изомером бутина-1 является вещество:
A) СН2=СН - С2Н5
Б) СН3 – СН – СН3
׀
СН3
В) НС ≡С – С2Н5
Г) Н2С = СН – СН2 – СН3
18. При повышении давления химическое равновесие сместится в сторону исходных веществ в системе…
А)2SO2 + O2
Б) CH4 + H2O
В) CO + 2H2
Г) 4HCl + O2
19. «Бесцветная жидкость с резким запахом, легче воды, хорошо растворим в воде, гигроскопичен, обладает бактерицидными свойствами» - данные свойства соответствуют:
А) бензол Б) этиловый спирт В) сахароза Г) бензол
20. Название вещества
а) 3 метал 5 пропил гептан б) 3 пропил 5 метил гептен3
в) 3 пропил 5 метил гептан г) 2, 5 диметил 3этил гептен 3
21. (Выбрать несколько вариантов ответа)С какими веществами взаимодействует HNO3
а) HCL б) Mg в) P2O5 г) Fe2O3
22. (Выбрать несколько вариантов ответа)Выбрать кислоты:
А) MgCl2 Б) Al(OH)3 В) H3PO4 Г) HF Д) NaOH Е) CO2
23. (Выбрать несколько вариантов ответа)Прочитать текст.
Для изготовления активированного угля используют различные углеродсодержащие материалы органического происхождения: торф, каменноугольный кокс, древесный и коксовый угли. В результате получают вещество, обладающее высокими адсорбирующими и каталитическими свойствами. Именно большое количество пор обуславливает мощную впитывающую способность активированного угля, который используют для поглощения токсических веществ, газообразных соединений. Однако при этом уголь слабо поглощает такие соединения, как щелочи и кислоты. Использование активированного угля эффективно впервые 12 часов после отравления. При отравлении, в том числе тяжелом, активированный уголь нужно принимать еще до промывания желудка. Принимать уголь нужно в расчете 1 таблетка на 10 кг веса. Попадая в организм уголь, подобно губке, впитывает в себя вредные вещества и спустя некоторое время естественным путем выводится вместе с ними.
Выбрать истинные суждения, согласно тексту.(Ответов несколько)
А) Активированный уголь делают из древесного угля
Б) Лучше всего уголь использовать после промывания желудка
В) Активированный уголь эффективен при любых отравлениях
Г) Для подростка весом 60кг нужно выпить 3 таблетки угля
Д) Для подростка весом 60кг нужно выпить 6 таблеток угля
Е) Активированный уголь является адсорбентом
Ж) Эффективнее использовать порошок угля чем таблетки
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ковалентная полярная
2) ионная
А) NaCl Б) HCl В) Mg(OH)2 Г) Cl2 Д) NO2
Ответ оформите в виде таблицы:
1 | 2 |
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) суспензия
2) порошок
3) гель
А) мука Б) компот В) цукаты Г) холодец
Ответ оформите в виде таблицы:
1 | 2 | 3 |
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С4Н10 1) Алканы
Б) С6Н12 2) Алкены
В) С2Н6 3) Алкины
Г) С4Н8
Д) С8Н16
Е) С5Н8
Часть С
21. В 15%-ном раствор кислоты массой 300 г добавили 30г. Рассчитайте массовую долю серной кислоты в полученном растворе.
30.Записать два изомера и два гомолога для 2- метил пентана
31.Осуществить схему превращений:
CH3 ─ CH3 → CH2 ═CH2 → CH ≡CH
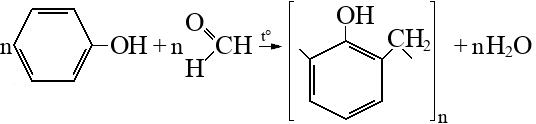
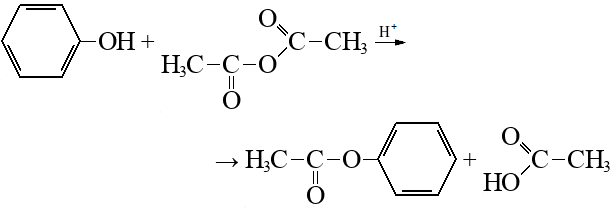
Строение, свойства и применение фенола.
СМОТРИМ ВИДЕО, КОНСПЕКТИРУЕМ, УЧИМ.
(из текста можете записать то, чего нет в видео.)
| Предложенное название | Фенол |
| Синонимы | Гидроксибензол Карболовая кислота |
| Классы | Одноатомные фенолы |
| Молярная масса | 94 г/моль |
| Брутто-формула | C6H6O |
| t°пл | 40,9 °C |
| t°кип | 182 °C |
| Плотность | 1,07 г/см3 |
| Бесцветные игольчатые кристаллы со специфическим запахомн.у. | |
| Изомеры | Показать 10 изомеров |
Простейший представитель фенолов (соединений с группой -OH при ароматическом ядре).
Растворимость в воде (6г на 100мл). Растворим в спирте, в ацетоне, в бензоле.
В природе содержится в каменноугольной смолеw.
Основной современный промышленный способ получения – «кумольный способ» (окисление кумола с получением фенола и ацетона). Ранее в основном выделялся из каменноугольной смолы.
Фенол – сырье для получения важнейших полимеров (фенолформальдегидные смолы, нейлон, капрон, эпоксидные смолы и др). Также используется в производстве ПАВ, лекарств, антисептиков и др соединений.
Фенол – токсичное вещество, при попадании растворов на кожу вызывает раздражение или даже ожоги, при попадании внутрь организма поражает нервную систему.
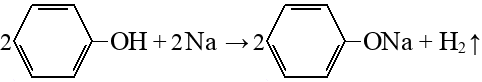
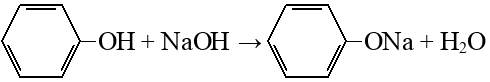
Гидрирование аренов
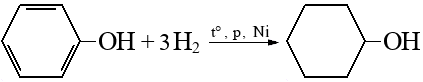
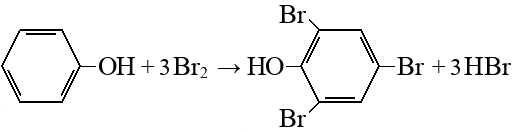
Сульфирование
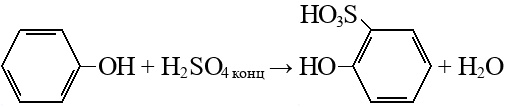
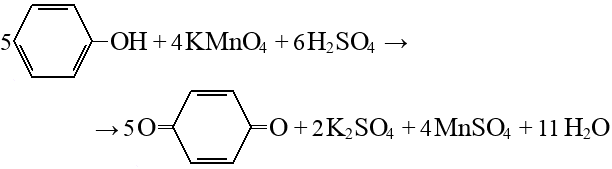
Горение органических веществ в кислороде – химическая реакция полного окисления кислородом. Окисление углеводородов продолжается до углекислого газа и воды:

Чтобы инициировать реакцию, необходимо нагревание в начале, однако, так как реакция весьма экзо-термическая, дальнейший ее ход обеспечивается выделением тепла в процессе.
Результат реакции горения не зависит от класса органического соединения и строения молекулы, имеет значение только количественный атомарный состав (брутто-формула) молекулы.
Сначала подсчитаем число молекул углекислого газа и воды, которые выделятся в процессе горения. Например, пропан (C3H8) состоит из трех атомов углерода и восьми водородов, значит при горении одной молекулы пропана выделится три молекулы CO2 и четыре молекулы воды.
Видим, что продукты горения пропана содержат суммарно 10 атомов кислорода, следовательно, для сгорания потребуется 5 молекул O2, окончательный вид уравнения:
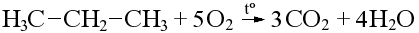
Если число атомов кислорода в продуктах нечетное, удваиваем все коэффициенты:
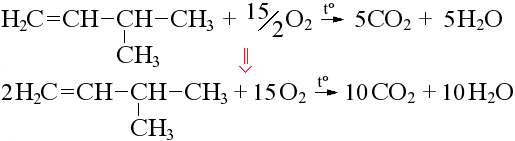
При уравнивании горения кислородсодержащих веществ учитываем, что часть атомов кислорода в продуктах идет от органического вещества, вычитаем их из числа атомов окислителя:
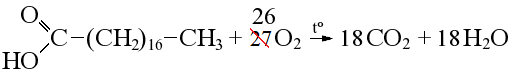
Азот, хлор и бром при горении выделяются в виде простых веществ:
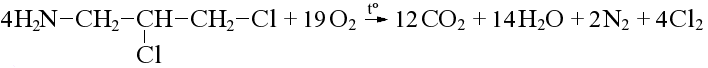
Реакция Кольбе-Шмитта – это карбоксилирование фенола по орто-положению в щелочной среде. Образуется салициловая кислота (орто-гидроксибензойная кислота):
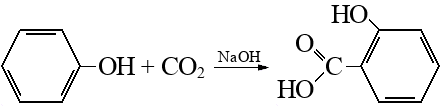
Реакцию проводят в две стадии. Так как карбоксилирование идет под действием щелочи, на первой стадии вместо кислоты образуется ее соль:
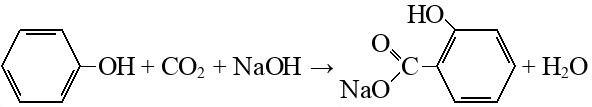
На второй стадии, чтобы получить кислоту, ее вытесняют из соли сильной минеральной кислотой: