ПОНЕДЕЛЬНИК, 07.02.22 г. 403, 405, 308
ВНИМАНИЕ!!! С 07.02 22 г. по 11.02.22 г. в нашем колледже проходит "Неделя науки и техники"! Уважаемые студенты, приглашаю вас принять активное участие! Пройдите по этой ссылке: https://rimmazosich.blogspot.com/p/7-11.html или по вкладке на главной странице: "Неделя науки и техники"
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ .
ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя.
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время;- разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 403 ХИМИЯ 46,47
ТЕМА: Каталитические реакции. Обратимые и необратимые реакции. Гомогенные и гетерогенные реакции.ТЕМА: Экзотермические и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения.
Катализ
Химические реакции подразделяются на каталитические и некаталитические. Каталитические реакции проводятся в присутствии катализаторов – веществ, которые, не вступая в химическое взаимодействие, способны изменять скорость реакции.
Химическое явление ускорения реакции с помощью катализатора называется положительным катализом или просто катализом. Отрицательным катализом называется явление уменьшения скорости протекания реакции под действием специальных веществ – ингибиторов.
Экономическая эффективность катализа проявляется в том, что благодаря использованию катализаторов процесс, как правило, протекает при более низкой температуре, что уменьшает энергетические затраты.
Каталитические реакции лежат в основе производства серной и азотной кислот, аммиака, водорода, процессов получения полимеров и переработки нефти. Особенно широко используют катализ в производстве спиртов, кислот, альдегидов, фенола, синтетических смол и пластмасс, искусственных каучуков и моторных топлив, красителей, лекарств и т.п.
Обратимые и необратимые химические реакции.
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ ![]() А+В; Обратная реакция.
А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В![]() АВ
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2![]()
Реакции гомогенные и гетерогенные.
Гомогенные реакции, т.е. для такие реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NO2(г) + CO(г) = NO(г) + CO2(г);
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. В качестве типичного примера гетерогенной реакции рассмотрим лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Zn(тв) + H2SO4(р-р) = H2(г) + ZnSO4(р-р)
Цинк в виде гранул (кусочки металла неправильной формы и разной величины) помещают в разбавленный раствор серной кислоты и собирают выделяющийся газообразный водород. В пробирке с одной крупной гранулой реакция идет заметно медленнее. При одинаковой массе цинка в пробирках количество выделившегося водорода в обоих опытах будет одинаковым, но в пробирке с мелкими гранулами реакция закончится быстрее. Причина в том, что реакция между цинком и раствором серной кислоты идет только на поверхности контакта гранул с раствором (граница раздела фаз), а общая поверхность у нескольких мелких гранул больше, чем у одной крупной гранулы той же массы. Цинк в виде порошка для этой реакции использовать просто опасно – реакция начинает идти настолько быстро, что смесь выплескивается из пробирки.
I. Тепловой эффект химической реакции.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q). Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
2 H2(г) + O2(г) = 2 H2О(ж) + Q
Это уравнение реакции называется термохимическим уравнением. Здесь символ "+Q" означает, что при сжигании водорода выделяется теплота. Эта теплота называется тепловым эффектом реакции. В термохимических уравнениях часто указывают агрегатные состояния веществ.
еакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского "экзо" – наружу). Например, горение метана:
CH4 + 2O2 = CO2 + 2H2O + Q
Реакции протекающие с поглощением энергии называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.
C + H2O = CO + H2 – Q
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы.
Самая мощная в мире российская ракета "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах - водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект - это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
Задача 1.
По термохимическому уравнению 2Cu + O2 = 2CuO + 310 кДж
вычислите количество теплоты, выделившейся в результате окисления 4 моль меди.
Дано: n(Cu)=4 моль
Найти: =?
Решение:
1) Над формулами веществ надпишем сведения, взятые из условия задачи, а под формулой – соотношение, отображаемое уравнением реакции
4моль X кДж
2Cu + O2 = 2CuO + 310 кДж
2 моль
2. Находим выделившееся количество теплоты, решая пропорцию:
X= 4 моль *310/2 моль=620 кДж
Ответ: Количество выделившейся теплоты 620 кДж.
ГРУППА 405 ХИМИЯ 16,17
ТЕМА: Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.ТЕМА: Ковалентная химическая связь. Механизм образования ковалентной связи (обменный и донорно-акцепторный). Электроотрицательность. Ковалентные полярная и неполярная связи.
Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО

Свойства ионных кристаллов:
- твердые, но хрупкие;
- отличаются высокими температурами плавления;
- нелетучи, не имеют запаха;
- расплавы ионных кристаллов обладают электропроводностью;
- многие растворимы в воде. При растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Различные типы связей могут содержаться в одних и тех же веществах.
1. В основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруп- пой — ионная.
2. В солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная.
3. В солях аммония, метиламмония и т. д. между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная.
4. В пероксидах металлов (например, Na2O2) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т. д.
- ЗАПОМНИ. Ковалентная связь образуется по обменному механизму, когда атомы образуют общие электронные пары. Ковалентная связь образуется по донорно-акцепторному механизму, когда донор имеет электронную пару, а акцептору принадлежит свободная орбиталь, которую эта пара может занять.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменный и донорно-акцепторный.
1. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
1) Н2 — водород.
Связь возникает благодаря образованию общей электронной пары s-электронами атомов водорода (перекрыванию s-орбиталей).
2) HCl — хлороводород.

Связь возникает за счет образования общей электронной пары из s- и р-электронов (перекрывания s-р-орбиталей).

3) Cl2: в молекуле хлора ковалентная связь образуется за счет непарных р-электронов (перекрывание р-р-орбиталей).

4) N2: в молекуле азота между атомами образуются три общие электронные пары.

2. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на примере иона аммония NH4+.

Донор имеет электронную пару, акцептор — свободную орбиталь □, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи классифицируют по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
а) H· + ·H  H:H
H:HH-H H2 (одна общая пара электронов; H одновалентен); б) 
N  N
NN2 (три общие пары электронов; N трехвалентен); в) 
H-F HF (одна общая пара электронов; H и F одновалентны); г) 

NH4+ (четыре общих пары электронов; N четырехвалентен) - По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную. Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются + и
+ и  -, например:
-, например:  .
.
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на -связь и
-связь и  -связь.
-связь. -Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов),
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов),  -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
-связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Практическая работа №6. Распознавание пластмасс и волокон.
Тема: «Распознавание пластмасс и волокон»
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Полимерами называют вещества, молекулы которых состоят из множества повторяющихся структурных звеньев, соединенных между собой химическими связями. Существует два основных способа получения полимеров — реакции полимеризации и реакции поликонденсации.
Реакция полимеризации — это химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы ) полимера.
В реакцию полимеризации могут вступать соединения, содержащие кратные связи, то есть непредельные соединения. Это могут быть молекулы одного мономера или разных мономеров.
В первом случае происходит реакция гомополимеризации — соединение молекул одного мономера, во втором — реакция сополимеризации — соединение молекул двух и более исходных веществ.
К реакциям гомополимеризации относятся реакции получения полиэтилена, полипропилена, поливинилхлорида и т. д., например:
Выражение в скобках называют структурным звеном, а число n-в формуле полимера — степенью полимеризации.
К реакциям сополимеризации относится, например, реакция получения бутадиен-стирольного каучука.
Реакция поликонденсации — это химический процесс соединения исходных молекул мономера в макромолекулы полимера, идущий с образованием побочного низкомолекулярного продукта (чаще всего воды).
В реакции поликонденсации вступают молекулы мономеров с функциональными группами.
Например, реакция получения фенолформальдегидных смол: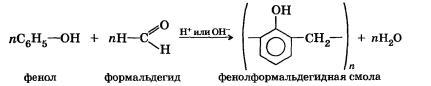
С помощью реакций поликонденсации получают полиэфиры, полиамиды, полиуретаны, полиакрил и т. д.
Пластмассы.
Пластмассами называют материалы, изготовляемые на основе полимеров. Пластмассы сочетают в себе разнообразные ценные качества, такие как лёгкость, прочность, химическая
стойкость и др., которые обусловили проникновение их в различные отрасли народного хозяйства. Кроме полимеров (их часто называют смолой) в пластмассах почти всегда содержатся другие компоненты, придающие материалу определённые качества. Полимерное вещество является для них связующим.
В пластмассы входят наполнители (древесная мука, ткань, асбест, стекловата и др.), которые улучшают их механические свойства.
Пластификаторы – повышают эластичность, устраняют хрупкость.
Стабилизаторы – способствуют сохранению свойств пластмасс в процессе их переработки и использования; красители придают необходимую окраску.
Обычные способы получения полимеров – это реакции полимеризации, лежащие в основе получения термопластичных пластмасс, и реакции поликонденсации, лежащие в основе получения термореактивных пластмасс.
Термопластичные полимеры при нагревании размягчаются и в этом состоянии легко изменяют форму, которую сохраняют при охлаждении. При следующем нагревании они снова размягчаются и могут принимать новую форму.
Термореактивные полимеры при нагревании сначала становятся пластичными, при дальнейшем нагревании утрачивают пластичность, становятся неплавкими. Повторно переработать такой полимер в новое изделие невозможно.
Наиболее типичными способами получения изделий из термопластичных пластмасс является литьё под давлением и экструзия (выдавливание), а из термореактивных пластмасс – горячее прессование.
Краткая характеристика некоторых пластмасс
Полиэтилен – твёрдый, жирный на ощупь, белого цвета термопластичный полимер. Стоек по отношению к агрессивным средам. Благодаря высокой температуре плавления, обладает существенными преимуществами перед другими материалами (полиэтиленом, полиметилметакрилатом, поливинилхлоридом), близким по свойствам.
Полипропилен идёт на изготовление высокопрочной изоляции, труб, деталей машин, химической аппаратуры. Благодаря высокой механической прочности, его используют для изготовления канатов, сетей, технических тканей.
Поливинилхлорид – обладает большой химической стойкостью, хорошими электроизоляционными свойствами и большой механической прочностью. Термопластичный полимер, на его основе изготавливают два вида пластмасс: винипласт, обладающий значительной жесткостью и пластикат – более мягкий материал.
Винипласт идёт на изготовление химически стойкой аппаратуры, ванн для никелирования, жестких плёнок. Пластикат используется для изоляции, для производства предметов широкого потребления (плащей, сумок, линолеума, клеенок, для получения материалов, заменяющих кожу – в производстве обуви).
Полиметилметакрилат – за свою прозрачность называется органическим стеклом. Обладает удовлетворительной прочностью и значительно меньшей хрупкостью, чем обычное силикатное стекло, способностью пропускать ультрафиолетовые лучи. Термопластичный полимер, находит применение в строительстве, в часовом деле, различных отраслях промышленности и в быту.
Фенолформальдегидная смола – обычно используется в смеси с наполнителями, красителями и т.п., а затем уже производят формование изделий способом горячего прессования. Термореактивный полимер. Введение различных наполнителей позволяет получить материалы, имеющие ценные свойства. Так текстолит и стеклотекстолит, армированные текстильными тканями и стеклотканью, по прочности близки к дюралюминию и стали.
Текстолит – хлопчатобумажная ткань, пропитанная фенолформальдегидной смолой и спрессованная при повышенной температуре. Устойчив к нагрузкам. Легко поддаётся механической обработке. Применяется для изготовления шарикоподшипников, шестерёнки для машин, предусмотренных для больших нагрузках.
Таблица 1 « Распознавание пластмасс»
Название пластмассы | Отношение к нагреванию | Характер горения |
Полиэтилен | Размягчается – можно вытянуть нить. | Горит синеватым пламенем, распространяя слабый запах горящего парафина. При горении отделяются капли. Вне пламени продолжает гореть. |
Поливинилхлорид (полихлорвинил) | Размягчается при 60-70˚С, выше 110-120˚С разлагается. | Горит коптящим пламенем. Вне пламени не горит. |
Полистирол | Размягчается – легко вытягиваются нити. | Горит коптящим пламенем, распространяя специфический запах. Вне пламени продолжает гореть. |
Полиметилметакрилат (орг. стекло) | Размягчается. | Горит жёлтым пламенем, с синей каймой у краев, с характерным потрескиванием, распространяя резкий запах. |
Целлулоид | Разлагается. | Горит очень быстро, оставляя следы золы. |
Фенолформальдегидные пластмасы | Разлагается при сильном нагревании | Загорается с трудом, при горении обугливается, распространяя резкий запах фенола. Вне пламени постепенно гаснет, не размягчается. |
Волокна
– природные или искусственные высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие, особыми физическими свойствами, позволяющими использовать их для получения нитей. Волокна делят на натуральные (природные) и химические. Натуральные волокна могут быть растительного или животного происхождения. Химические волокна в свою очередь подразделяют на искусственные и синтетические.
Природные волокна:
Волокно растительного происхождения – хлопок, лен.
Хлопковое волокно получают из субтропического растения – хлопчатника. Хлопковое волокно легкое, достаточно прочное, мягкое, гигроскопичное.
Волокна животного происхождения – шерсть и шелк.
Шелк вырабатывают многочисленные гусеницы и пауки.
Шерсть – волокна волосяного покрова овец, коз, верблюдов и других животных.
Искусственные волокна:
Наибольшее значение среди искусственных волокон занимают ацетатное и вискозное волокна, получаемые из древесной целлюлозы.
Синтетические волокна:
из синтетических волокон наибольший интерес представляют полиамидное волокно – полиамид – 6 (капрон) и полиэфирное – полиэтиленгликольтерефталат (лавсан).
Капрон получают из капролактала, который под воздействием воды размыкает цикл, образуя ε – капроновую кислоту. Из этой кислоты в результате поликонденсации образуется полимер линейной структуры:
n H2N – (CH2)5 – COOH → [- NH – (CH2)5 – CO -]n + (n-1)H2O
Лавсан (полиэтилентерефталат) - представитель полиэфиров:

Получают реакцией поликонденсации терефталевой кислоты и этиленгликоля:
HOOC-C6H4-COOH + HO-CH2CH2-OH + HOOC-C6H4-COOH + … →
→ HOOC-C6H4-CO – O-CH2CH2-O – OC-C6H4-CO – … + nH2O
полимер-смола
В общем виде:
n HOOC-C6H4-COOH + n HO-CH2CH2-OH →
→ HO-(-CO-C6H4-CO-O-CH2CH2-O-)n-H + (n-1) H2O
Таблица 2. «Распознавание волокон»
Волокно | Сжигание |
Хлопок | Горит быстро с запахом жжёной бумаги. После горения остается серый пепел. |
Шерсть | Горит медленно с запахом жжёных перьев. После горения образуется хрупкий чёрный шарик, растирающийся в порошок. |
Ацетатное волокно | Горит быстро, образуя нехрупкий спёкшийся тёмно-бурый шарик. Вне пламени горение постепенно прекращается. |
Капрон | Плавится, образуя твёрдый блестящий шарик тёмного цвета. При горении распространяется неприятный запах. |
Лавсан | Плавится, затем горит коптящим пламенем с образованием тёмного твердого блестящего шарика. |
Нитрон | Горит, образуя тёмный рыхлый неблестящий шарик. |
Вопросы для закрепления .
Дайте определения следующим понятиям: полимеры, структурное звено, степень полимеризации.
В чем разница между реакциями полимеризации и поликонденсации?
Какие полимеры называются термопластичными?
Какие полимеры называются термоактивными.