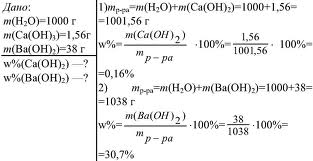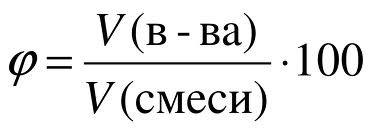Среда, 28.10.20г. 301, 108, 205, 106 группы
Гр.301 Тема Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
ЗАДАНИЕ: прочитать текст, сделать записи , просмотреть видео, выполнить тесты.
Основные термины:
Массовая доля – отношение массы растворенного вещества к общей массе раствора.
Объемная доля – отношение объема данного вещества к общему объему смеси.
Ход урока:
1. Проверка изученного.
1. Среди приведенных объектов выберите самый маленький по размеру:
а) бактерия;
б) молекула;
в) маковое зернышко;
г) песчинка.
2. В каком ряду все перечисленные вещества относятся к простым?
а) мел, углерод, озон;
б) алмаз, кислород, гранит;
в) сера, фосфор, озон;
г) крахмал, водород, железо.
3. Очень важной для живой природы особенностью физических свойств воды является то, что:
а) температура кипения воды равна 100º С;
б) плотность жидкой воды выше плотности льда;
в) температура замерзания воды равна 0º С;
г) вода обладает очень низкой электропроводностью.
4. Соединений, содержащих только атомы водорода и кислорода:
а) не известно ни одного;
б) известно только одно;
в) известно несколько;
г) известно огромное количество.
5. При взаимодействии кислорода с металлами:
а) образуются соли;
б) выделяется озон;
в) образующиеся соединения всегда являются оксидами;
г) образующиеся соединения не всегда являются оксидами.
Растворы в природе.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода.
Вы уже знаете, что природная вода никогда не бывает совершенно чистой. Так, существует вода, которая содержит значительное количество солей кальция и магния и называется жесткой (есть также мягкая вода, например дождевая). Жесткая вода дает мало пены с мылом, а на стенках котлов и чайников при ее кипячении образуется накипь. На рисунке 1 вы можете посмотреть, как жесткая вода образует накипь. Жесткость воды зависит от количества растворенных в ней солей. Содержание растворенного вещества в растворе выражают с помощью ее массовой доли.
Рис.1. Влияние жесткой воды
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
В ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром. Чистое золото — металл слишком мягкий, ноготь оставляет на нем след. износостойкость его невелика. Проба, стоящая на золотых изделиях, изготовленных в нашей стране, означает массовую долю золота в сплаве, точнее, содержание его из расчета на тысячу массовых частей сплава. Проба 583°, например, означает, что в сплаве массовая доля золота составляет 0,583 или 58,3%.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).
Рис.2. Массовая доля компонентов смеси.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).
Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
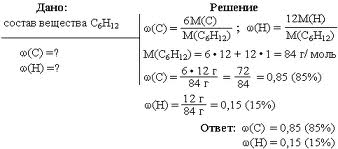
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5.
Рис.4. Задача на нахождение массовой доли.
Рис.5. Задача на нахождение массовой доли (в процентах).
Объемная доля.
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6):
Рис. 6. Объемная доля.
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7).
Рис.7. Объемная доля благородных газов в воздухе.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Давайте посмотрим, как решать задачи на нахождение объемной доли (рисунок 8).
Рис.8. Задача на нахождение объемной доли.
Выводы.
1. Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
2. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах.
3. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой фи.
Контролирующий блок.
1. Что такое массовая доля растворенного вещества?
2. Что такое объемная доля компонента в газовой смеси?
3. Сравните понятия «объемная доля» и «массовая доля» компонентов смеси.
ГРУППА 108. ТЕМА: Производство серной кислоты контактным способом.
ЗАДАНИЕ: ПРОЧИТАТЬ ТЕКСТ, ВЫПОЛНИТЬ КРАТКО НЕОБХОДИМЫЕ ЗАПИСИ.
Производство серной кислоты контактным способом
“Едва ли найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов для ее добывания - немыслимо выгодное производство многих других веществ, имеющих важное технические значение” Д.И. Менделеев Серная кислота применяется в разнообразных производствах химической промышленности:
Производство серной кислоты Серную кислоту в промышленности производят двумя способами: контактным и нитрозным. Контактный способ производства серной кислоты Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах. В настоящее время основным методом производства серной кислоты является контактный, т.к. этот метод имеет преимущества перед другими: - получение продукта в виде чистой концентрированной кислоты, приемлемой для всех потребителей; - уменьшение выбросов вредных веществ в атмосферу с выхлопными газамиI. Сырьё, используемое для производства серной кислоты. Основное сырьё сера - S серный колчедан (пирит) - FeS2 сульфиды цветных металлов - Cu2S, ZnS, PbS сероводород – H2S Вспомогательный материал катализатор - оксид ванадия – V2O5 II. Подготовка сырья. Разберём производство серной кислоты из пирита FeS2. 1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ. 2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют. III. Основные химические процессы: 4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q или сжигание серы S + O2 t °C→ SO2 2SO2 + O2 400-500°С,V2O5,p↔2SO3 + Q SO3 + H2O → H2SO4 + Q IV. Технологические принципы: - принцип непрерывности; - принцип комплексного использования сырья, использование отходов другого производства; - принцип безотходного производства; - принцип теплообмена; - принцип противотока (“кипящий слой”); - принцип автоматизации и механизации производственных процессов. V. Технологические процессы: Принцип непрерывности: обжиг пирита в печи →поступление оксида серы (IV) и кислорода в очистительную систему →в контактный аппарат →подача оксида серы (VI) в поглотительную башню. VI. Охрана окружающей среды: 1) герметичность трубопроводов и аппаратуры 2) газоочистительные фильтры VII. Химизм производства: ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое". Для получения серной кислоты используют, в основном, флотационный колчедан - отход производства при обогащении медных руд, содержащих смеси сернистых соединений меди и железа. Процесс обогащения этих руд происходит на Норильской и Талнахской обогатительных фабриках, которые и являются основными поставщиками сырья. Это сырье является более выгодным, т.к. серный колчедан добывают, в основном, на Урале, и, естественно, доставка его может быть очень дорогостоящей. Возможно использование серы, которая также образуется при обогащении руд цветных металлов, добываемых на рудниках. Поставщиками серы являются также ТОФ и НОФ. (обогатительные фабрики). Уравнение реакции первой стадии 4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета. В “кипящем слое” не слеживаются даже самые мелкие частицы пирита. Поэтому процесс обжига происходит очень быстро. Если раньше для обжига пирита требовалось 5-6 часов, то теперь - всего несколько секунд. Притом, в “кипящем слое” можно поддерживать температуру 800°С. За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений. Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве). Таким образом, выполняется принцип химического производства - безотходность производства. Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды. Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз). Для удаления мелких частиц смесь направляем в электрофильтры, где идет очищение под действием тока высокого напряжения ~ 60000 В (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду. Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. Для увеличения поверхности соприкосновения газа и жидкости башню заполняют керамическими кольцами. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2. ВТОРАЯ СТАДИЯ – каталитическое окисление SO2 в SO3 кислородом в контактном аппарате. Уравнение реакции этой стадии: 2SO2 + O2 400-500°С,V2O5,p ↔2SO3 + Q Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3). Из уравнения следует, что реакция обратимая, а, значит, на этой стадии необходимо поддерживать такие условия, чтобы равновесие смещалось в сторону выхода SO3, иначе нарушится весь процесс. Т.к. реакция идет с уменьшением объема (3V↔2V), то необходимо повышенное давление. Повышают давление до 7-12 атмосфер. Реакция экзотермическая, поэтому, учитывая принцип Ле-Шателье, при высокой температуре этот процесс вести нельзя, т.к. равновесие сдвинется влево. Начинается реакция при температуре = 420 градусов, но благодаря многослойности катализатора (5 слоев), мы можем ее повышать до 550 градусов, что значительно ускоряет процесс. Катализатор используют ванадиевый (V2O5). Он дешевый, долго служит (5-6 лет), т.к. наиболее устойчив к действию ядовитых примесей. Кроме того, он способствует сдвигу равновесия вправо. Смесь (SO2 и O2) нагревается в теплообменнике и движется по трубам, между которыми в противоположном направлении проходит холодная смесь, которую надо нагреть. В результате происходит теплообмен: исходные вещества нагреваются, а продукты реакции охлаждаются до нужных температур. ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой в поглотительной башне. А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O →H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Уравнение реакции этого процесса: nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. Использованы материалы: |
Химическая номенклатура:
это совокупность названий индивидуальных веществ, их групп и классов, а также правила составления этих названий. Номенклатурные правила, разрабатываемые международным союзом чистой и прикладной химии (IUPAC), приняты в большинстве стран мира.
Согласно правилам IUPAC существуют следующие названия органических соединений:
- систематические
-тривиальные
- полусистематические-полутривиальные
Систематические названия полностью составляются из слов и частиц, которые отражают определенные элементы строения молекулы и опиcывают структурные особенности соединения, например:


Систематическая номенклатура используется во всем мире, употребляет международную терминологию и отражает состав, а также химическое и пространственное строение соединения.
Тривиальные названия не зависят от структуры и часто связаны с источником выделения или способом получения данного соединения. Например, яблочная кислота:


Тривиальные названия представляют собой исторически сложившиеся названий, которые отражают природный источник вещества (молочная кислота, мочевина, кофеин), характерные свойства (глицерин, гремучая кислота) или имя первооткрывателя (кетон Михлера, углеводород Чичибабина). Тривиальные названия не отражают точный состав и строение вещества, но позволяют увидеть, к какому классу соединений относится соединение. Многие тривиальные названия достаточно лаконичны, общеупотребимы и эквивалентны во всем мире, например валериановая кислота (англ. valeric acid), ксилол (англ. xylol), пропионовый альдегид (англ. propionaldehyde). Поэтому употребление некоторых из них разрешено правилами IUPAC
В полусистематических-полутривиальных названиях лишь некоторые части применяются в систематическом смысле, например названия первых членов ряда алканов (метан, бутан) содержат тривиальные основы и систематический суффикс:

Для использования систематической номенклатуры ИЮПАК необходимо знать
следующие номенклатурные термины:
·
органический радикал;
·
родоначальная структура;
·
характеристическая группа;
·
заместитель.
Органический радикал – остаток молекулы, из которой удалены один или
несколько атомов водорода, при этом остаются одна или несколько валентностей.
Из двух первых представителей алканов – метана
и этана – получаются одновалентные радикалы – метил CH3- и этил CH3-CH2-. Названия одновалентных
радикалов обычно получают путём замены суффикса –ан на суффикс –ил.
Атомы углерода в цепи могут различаться по числу связей с соседними
атомами углерода. Если число таких связей четыре, то углерод называется четвертичным (четверт.), три – третичным (трет.), две – вторичным (втор.), одна – первичным (перв.) (Рис. 2.1).
Рис. Нумерация атомов углерода
по числу валентных связей углерод-углерод
Вещества, близкие по строению и очень похожие по химическим свойствам, но
различающиеся по молекулярному составу лишь на одну или несколько метиленовых
групп CH2,
называют гомологами. Гомологи
образуют гомологический ряд, где каждый последующий гомолог отличается
от предыдущего на одну метиленовую группу.
Каждый последующий гомолог из-за неравноценности атомов углерода образует
несколько радикалов. При отнятии атомов водорода от любого из двух первичных
атомов углерода пропана получают радикал н-пропил (нормальный пропил), а от
вторичного атома углерода – изопропил.
Бутан и изобутан, каждый образуют по два радикала. Буква н (нормальный) перед
названием радикала указывает, что свободная валентность находится на конце
неразветвлённой цепи. Приставка втор (вторичный) означает, что
свободная валентность находится у вторичного атома водорода (втор-бутил),
а приставка трет (третичный) - у
третичного атома углерода (трет-бутил).
Рис. Номенклатура углеводородных
радикалов
Распространёнными являются такие углеводородные радикалы, как винил CH2=CH-, аллил CH2=CH-CH2-, фенил C6H5-,
бензил C6H5CH2-. Углеводородные
радикалы алифатического ряда имеют общее название – алкилы (R), ароматического ряда - арилы (Ar).
!!!
Термины – первичный, вторичный и третичный атомы углерода – используют не
только в углеводородах, но и в других классах соединений.
Например галагенопроизводные и спирты в зависимости от того, у какого
атома углерода находится функциональная группа, называют первичными, вторичными
и третичными.
CH3CH2CH2CH2-Br CH3CH2CH2CH(CH3)-Br CH3C(CH3)2-Br
н-бутилбромид втор-бутилбромид
трет-бутилбромид
«Онтогенез. Эмбриональное развитие организма.»
Перечень вопросов, рассматриваемых в теме;
На уроке мы рассмотрим процесс индивидуального развития живых организмов. Вы узнаете, как из единственной клетки, проходя сложный путь преобразований, развивается целый организм. Какие стадии жизненного цикла общие у представителей разных систематических групп. Какое воздействие оказывают факторы среды на развитие организма в зародышевом периоде.
Глоссарий по теме (перечень терминов и понятий, введенных на данном уроке);
Онтогенез, типы онтогенеза, эмбриональный период, постэмбриональный период, морула, бластула, бластоцель, гаструла, нейрула, эктодерма, энтодерма, мезодерма, эмбриональная индукция, метаморфоз
Эмбриология - наука об индивидуальном развитии организмов.
Онтогенез – процесс индивидуального развития особи от момента образования зиготы до конца жизни организма.
Эмбриональное развитие - период жизни организма, который начинается с образования зиготы и заканчивается рождением или выходом зародыша из яйца.
Дробление — многократное деление зиготы путем митоза.
Бластула – однослойный зародыш с полостью внутри;
Гаструляция - двухслойный зародыш
Нейрула трехслойного зародыша - появление третьего, среднего слоя клеток — мезодермы, завершение образования трех зародышевых листков;
Постэмбриональное развитие
Теоретический материал для самостоятельного изучения;
Онтогенез – индивидуальное развитие организма.
Эмбриональный период, именуемый эмбриогенезом, берёт начало с соединения ядер женской и мужской половых клеток и представляет собой процесс оплодотворения. Так, у тех организмов, которым свойственно внутриутробное развитие, эмбриогенез заканчивается рождением, у организмов с личиночного типа развитием – выходом из зародышевых оболочек.
Эмбриональный период развития имеет несколько стадий:
1.Зигота. При оплодотворении мужская половая клетка, достигая яйцеклетки, провоцирует её развитие. В ней начинают происходить химические и физические процессы, которые способствуют образованию симметрии яйцеклетки, ликвидации мембран ядер, в результате чего, ядра двух клеток соединяются, и образуется ДНК.
2. Дробление (первый этап развития зиготы) – начинается деление зиготы. В яйцеклетке, которая продвигается по фаллопиевой трубе, образуются борозды, благодаря чему происходит деление клеток. Образовавшиеся таким путём клетки называются морулы. Эту стадию проходят все многоклеточные организмы, которые размножаются половым путём, различным является только процесс деления клеток (радиальное, билатеральное, спиральное). Особенностью деления клеток является то, что они не растут. Этот процесс предполагает образование из одной крупной клетки (яйцеклетки) большого количества клеток мелких, с меньшим количеством цитоплазмы возле ядер. Эмбриональный период на этом не заканчивается, рассмотрим следующие стадии развития эмбриона.
3. Бластула (образование многоклеточной структуры в форме пузырька) – состоит из слоя клеток, которые именуются эмбриональными. Размер бластулы приближается к размерам яйцеклетки, поэтому при делении клеток, возрастает число ядер и ДНК.
4. Гаструляция – стадия движения клеток эмбриональных, в результате чего образуются три слоя зародышевых листов. Эта стадия характеризуется возрастанием синтеза белков и рибосом, в этот период происходит выпячивание полюса (вегетативного) внутрь бластулы, противоположные полюса соединяются, и полость бластулы ликвидируется. При этом образуется новая полость, которая получила название бластопор или первичный рот.
Таким образом, гаструляция является необходимым моментом развития эмбриона, поскольку эмбриональный период на этой стадии даёт возможность формированию его органов и тканей, а также систем организма. Следует отметить, формирование тканей и органов эмбриона в разные периоды имеют разную чувствительность к повреждающим воздействиям среды, например, к инфекциям, радиации или химическим агентам. Эти периоды повышенной чувствительности называют критическими, здесь повышается вероятность развития отклонений.
Так, эмбриональный период имеет несколько критических моментов. Рассмотрим их более детально: 1. Период бластулы (первые две недели после зачатия) – эмбрион либо погибает, либо продолжает развиваться без отклонений. В это время погибает большое количество эмбрионов (40%), которые начали своё развитие из мутированных половых клеток. 2. С двадцатого по семидесятый день после оплодотворения – период наибольшей ранимости эмбриона, поскольку начинают закладываться и формироваться все жизненно важные органы. 3. Плодный период характеризуется быстрым ростом плода. Здесь довольно часто могут возникать нарушения его развития только в тех органах, которые не закончили своего формирования. Таким образом, эмбриональный период онтогенеза характеризуется формированием и развитием эмбриона путём делением клеток, образования у него тканей, органов и систем. У различных живых организмов этот период разнится по времени, но в любом случае, начинается он с момента зачатия и заканчивается рождением новой жизни
Эктодерма - наружный слой кожи – эпителий, нервная система, эмаль зубов, производные кожи: волосы, ногти, когти, рога, копыта, чешуя рыб, пресмыкающихся, кожные железы, органы чувств: глаза, уши и др.
Энтодерма - эпителий внутренних органов: кишечника, жабр, легких. Пищеварительные железы – печень, поджелудочная железа.
Мезодерма хрящевая и костная ткань, мышцы, почки, сердечно - сосудистая система, половые железы, дентин зубов.
примеры и разбор решения заданий тренировочного модуля (не менее 2 заданий).
Задание 1.
Установите последовательность стадий эмбриогенеза хордового животного. Запишите в таблицу, соответствующую последовательность цифр | |||||
Тип вариантов ответов: (Текстовые, Графические, Комбинированные). Варианты ответов 1) дробление зиготы 2) образование нейрулы 3) формирование гаструлы 4) образование бластулы 5) формирование зиготы Правильные варианты:
|
Задание 2.
Найдите три ошибки в приведённом тексте. Подчеркните предложения, в которых сделаны ошибки |
Тип вариантов ответов: (Текстовые, Графические, Комбинированные). Варианты ответов: 1. Эмбриональное развитие – эмбриогенез начинается с момента деления яйцеклетки и заканчивается рождением организма или выходом его из яйца. 2. Первый этап – дробление характеризуется быстрым делением без увеличения массы клеток эмбриона. 3. Дробление заканчивается образованием бластулы с бластоцелью внутри. 4. На стадии гаструлы у хордовых животных образуется гастральная полость, которая в дальнейшем превращается в кишку, формируются энтодерма, мезодерма и эктодерма. 5. На стадии нейрулы образуется нервная пластинка, которая преобразуется в нервную трубку, из которой в дальнейшем у позвоночных развивается головной и спинной мозг. 6. В конце стадии нейрулы в эмбриогенезе хордовых животных образуется осевой комплекс органов: хорда, под которой расположены нервная и кишечная трубки. Правильный вариант: 1. Эмбриональное развитие – эмбриогенез начинается с момента деления яйцеклетки и заканчивается рождением организма или выходом его из яйца. 2. Первый этап – дробление характеризуется быстрым делением без увеличения массы клеток эмбриона. 3. Дробление заканчивается образованием бластулы с бластоцелью внутри. 4. На стадии гаструлы у хордовых животных образуется гастральная полость, которая в дальнейшем превращается в кишку, формируются энтодерма, мезодерма и эктодерма. 5. На стадии нейрулы образуется нервная пластинка, которая преобразуется в нервную трубку, из которой в дальнейшем у позвоночных развивается головной и спинной мозг. 6. В конце стадии нейрулы в эмбриогенезе хордовых животных образуется осевой комплекс органов: хорда, под которой расположены нервная и кишечная трубки. 1 эмбриогенез начинается с момента оплодотворения и образования зиготы. 4 – мезодерма закладывается на стадии нейрулы. 6 – осевой комплекс органов хордовых – хорда, над которой расположена нервная трубка, под хордой – кишечная трубка с жаберными карманами в глотке |