12.12.22г. ПОНЕДЕЛЬНИК 501,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 17,18
ТЕМА 17:Ковалентная химическая связь. Механизм образования ковалентной связи (обменный и донорно-акцепторный). Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, называется ковалентной связью.
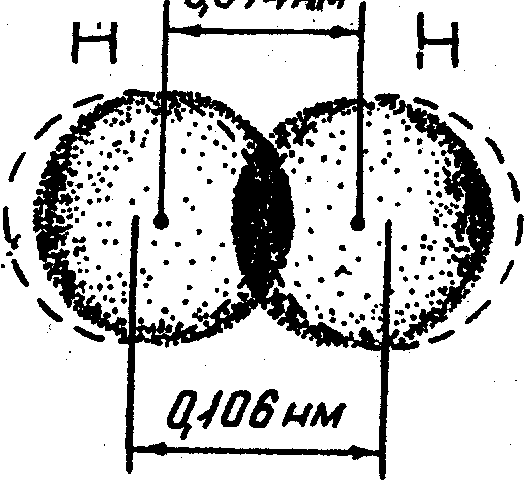
4.3.1. Неполярная ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода.
- Образование молекулы Н2. Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
Таким образом, ковалентная связь обеспечивается силами электростатического притяжения между сосредоточенной электронной плотностью в межъядерном пространстве, возникшей в результате перекрывания электронных облаков, и положительными зарядами ядер. Ковалентная связь тем прочнее, чем вше степень перекрывания электронных облаков. В результате возникновения связи между атомами водорода каждый атом достигает электронной
конфигурации инертного элемента гелия:
< Н ∙ + ∙ Н → Н: Н или Н2
Н ∙ + ∙ Н → Н: Н или Н2
Рис. 7. Схема перекрывания электронных орбиталей при образовании молекулы водорода
- Образование молекулы хлора С12. В молекуле хлора ковалентная связь осуществляется с помощью двух общих электронов или электронной пары. Из семи валентных электронов каждый атом хлора имеет по одному неспаренному. Образование химической связи происходит за счет неспаренных электронов
каждого атома. В результате
образуется общая электронная
пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента аргона:
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
: С1 ∙ + ∙ С1 → : С1 : С1 : или С12
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
Или, с точки зрения строения атома, это можно представить так:
электронная формула атома хлора Is22s22p63s23Sp5




↑↓ ↑↓ ↑↓ ↑
 3s 3р
3s 3р
При образовании молекулы происходит перекрывание р-орбиталей (рис. 8).
P P P - P




+ -














Cl Cl Cl2
Рис. 8. Схема образования химической связи в молекуле хлора.
с точки зрения строения атома электронная формула атома азота выглядит так:



 ↑↓ ↑ ↑ ↑
↑↓ ↑ ↑ ↑
2s 2р
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π).
Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
Наглядно это представлено на рисунке 9.
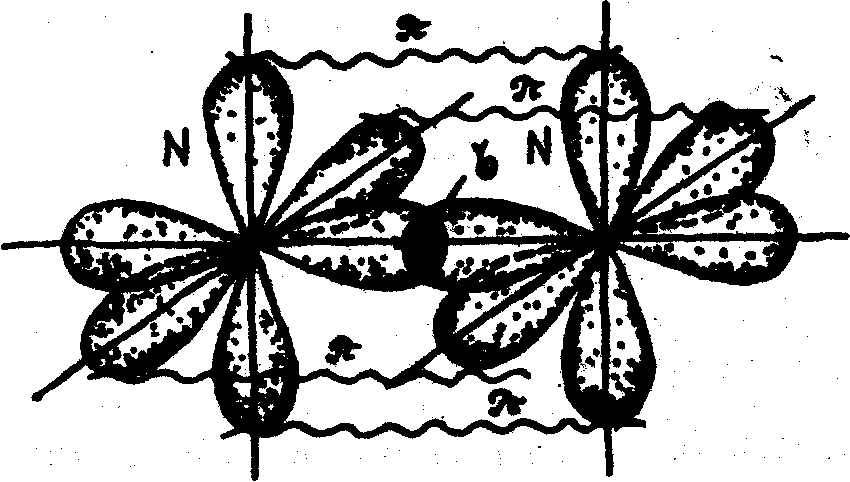
Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или гомеополярную ковалентную связь. При неполярной связи вероятность присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных и отрицательных зарядов совпадают. Центром положительного заряда считают середину расстояния между ядрами. В молекулах простых газообразных веществ Н2, CI2, O2, N2 - в газообразной фазе наблюдается гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной связью обладают низкими температурами кипения и плавления, в воде не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной связи. Простейший случай гетерополярной связи — это образование молекулы хлорводорода. Образование молекулы НС1 можно представить схемой:
. . . .
Н ∙ + ∙ С1 : → Н : С1:
∙ ∙ ∙ ∙
Здесь происходит перекрывание s-облака атома водорода и р-облака атома хлора (рис. 10).
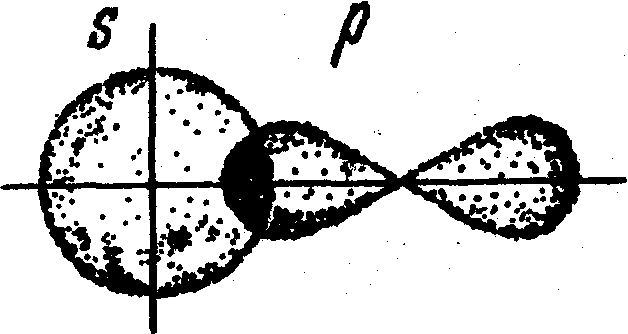
Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Но в данном случае хлор обладает большей относительной электроотрицательностью. Поэтому происходит оттягивание электронной плотности к атому хлора. В молекуле возникает положительный и отрицательный полюсы. Химическая связь, в которой электронная плотность смещена к одному из партнеров, называется гетерополярной или полярной ковалентной связью. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотри-цательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно атом получает заряд, называемый эффективным зарядом атома δ -. У второго атома повышается плотность положительного заряда δ +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя равный произведению эффективного заряда на длину диполя lд
μСВ = δ lд
Электрический момент диполя имеет единицу измерения кулон на метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3-10–30 Кл∙м
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
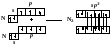
Рассмотренный выше механизм образования ковалентной связи (неполярной и полярной) называется обменным. Возможен и другой механизм образования ковалентной связи — донорно-акцепторной. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого. В качестве примера рассмотрим механизм образования иона аммония NH+:
NH3 + H+ → [NH4]+
В молекуле аммиака азот имеет неподеленную пару электронов (двухэлектронное облако). У иона водорода свободна ls-орбиталь. При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
H H
 .. . . +
.. . . +
H
 : N : + H+ → H NH :
: N : + H+ → H NH :
˙˙ ˙ ˙
H H
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором. Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Таким образом, в катионе аммония четыре равноценные ковалентные связи: три образованные по обменному механизму и одна - по донорно-акцепторному.
Вещества с полярной ковалентной связью занимают по свойствам промежуточное положение между веществами с ионной связью и неполярной ковалентной связью. Ковалентному типу связи характерны атомные и молекулярные кристаллические решетки.
Провести границу между ионной и полярной ковалентными связями не всегда возможно. В соединениях, образованных тремя и более элементами, между атомами могут быть различные типы химической связи.
4.3.3. Свойства ковалентной связи. Ковалентная связь обычно характеризуется длиной связи, энергией связи, насыщаемостью и направленностью.
Длиной связи называется межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Химическая связь тем прочнее, чем меньше ее длина. Однако количественной мерой прочности связи является ее энергия.
Энергия связи равна той энергии, которая необходима для разрыва имеющихся в молекуле связей. Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества, т. е. к 6,02 · 1023 связям. Так, согласно опытным данным, длины связи молекул водорода, хлора и азота соответственно составляют 0,074, 0,198 и 0,109 нм (нанометра), а энергии связи соответственно равны 436, 242 и 946 кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
Насыщаемость — это полное использование атомом валентных орбиталей. В результате он становится неспособным к установлению дополнительных связей. Например, нельзя присоединить еще атом водорода к молекулам Н2 или СН4. В этих молекулах связи насыщены. Благодаря насыщаемости связей молекулы имеют определенный состав: Н2, Н2О, НСl и т. д.
Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии соединения атомов. При образовании молекулы НС1 происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекула имеет линейную форму. Химические связи в молекуле воды направлены под углом 104,5°.
Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
омимо характеристик, общих для любой химической связи (энергия, длина), ковалентная связь имеет дополнительные особенности: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
Кратность
Между соединяемыми атомами могут образоваться одна, две или три ковалентные связи.
Кратность (или порядок) ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
Пару электронов между атомами изображают соединительной чертой – валентным штрихом.
При наличии одной электронной пары между соединяемыми атомами говорят о простой (ординарной, или одинарной) ковалентной связи.
Например, в молекулах Н2, F2, HF, Н2О, NH3, СН4, CH3СН3 или сложных ионах ОН-, [NH4]+, [Zn(OH)4]2-, [Cu(NH3)4]2+ все связи между атомами ординарные и являются σ-связями.

При наличии у соединяемых атомов двух или трёх общих электронных пар между ними имеется соответственно двойная или тройная ковалентная связь, при этом одна связь – обязательно σ-связь, остальные – π-связи.
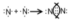
Примерами могут служить молекулы или многоатомные ионы, где между атомами есть кратные (двойные или тройные) связи: N≡N (азот), Н2С=СН2 (этилен), H2C=O (формальдегид), НС≡СН (ацетилен), О=N-O-, C≡N- (цианид - ион).
С увеличением кратности ковалентной связи уменьшается её длина и повышается прочность:
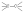
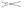
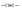
rсв, пм1 | 154 | 134 | 120 | ||
Δ r, пм | 20 | 14 | |||
Есв, кДж/моль | 350 | 607 | 829 | ||
Δ Есв, кДж/моль | 257 | 222 |
Однако увеличение энергии ковалентной связи, как видно из приведённых значений, не пропорционально увеличению её кратности, что указывает на различие в энергиях σ- и π-связи, причём Еσ > Еπ. Это обусловлено тем, что эффективность перекрывания атомных орбиталей при образовании σ-молекулярной орбитали выше, чем при образовании π-молекулярной орбитали.
ТЕМА 18:Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
В зависимости от частиц, которые стоят в узлах решетки, различают:
металлическую кристаллическую решетку;
ионную кристаллическую решетку;
молекулярную кристаллическую решетку;
макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Атомы расположены максимально близко друг к другу, очень плотно. Промежутки между атомами (шарами) очень малы, поэтому имеет место быть название, плотноупакованная структура. Существует 3 основных типа таких структур: гексагональная плотная упаковка (ГПУ), гранецентрированная кубическая упаковка (ГКУ) и объемно центрированная кубическая упаковка (ОЦКУ). Последняя менее плотная.
Вещества с металлической структурой обладают такими свойствами, как температура плавления, кипения, ковкость, плотность, теплопроводность и электропроводность.
Ионная связь кристаллических решеток.
В узлах кристалла находятся ионы, из-за этого тут превалируют электростатические силы, вследствие чего в структуре должна быть электрическую нейтральность. У каждого типа ионной решетки должно быть свое координационное число. Например, молекула хлорида натрия: Na+, Cl-. Каждый ион Na+ окружен 6-тью ионами Cl-, поэтому координационное число равно 6. И вокруг иона Cl- тоже 6 ионов натрия, поэтому тут в молекуле присутствует координация 6:6.
Вещества с таким типом решетки обладают высокой твердостью, они тугоплавки и малолетучи. Электричество проводят не только растворы, но и расплавы (т.к. ионные соединения диссоциируют в полярных жидкостях (вода).
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
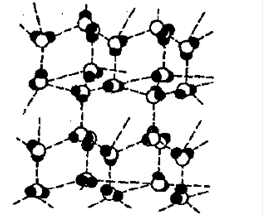
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
каркасные;
цепочечные;
слоистые структуры.
Каркасной структурой обладает алмаз – одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp3 – гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых - между слоями.
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша – «пишущее свойство» - 4ый слой остается на бумаге.
Графит – отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO3), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
ГРУППА 406 ХИМИЯ
ТЕМА 31,32:Межклассовая изомерия с алкадиенами.С.р.-проверка знаний.
ПРОВЕРЬТЕ СЕБЯ, ПРОЙДИТЕ ТЕСТ (фото итогов вышлите) ЗДЕСЬ:
https://studarium.ru/article-test/184
Тема 31: Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение.
Спирты
Это производные углеводородов, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3СН2ОН 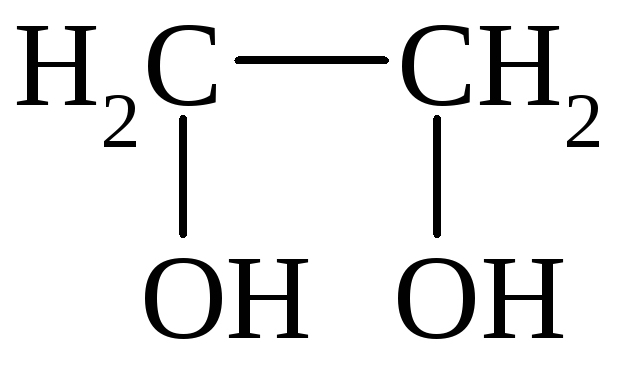
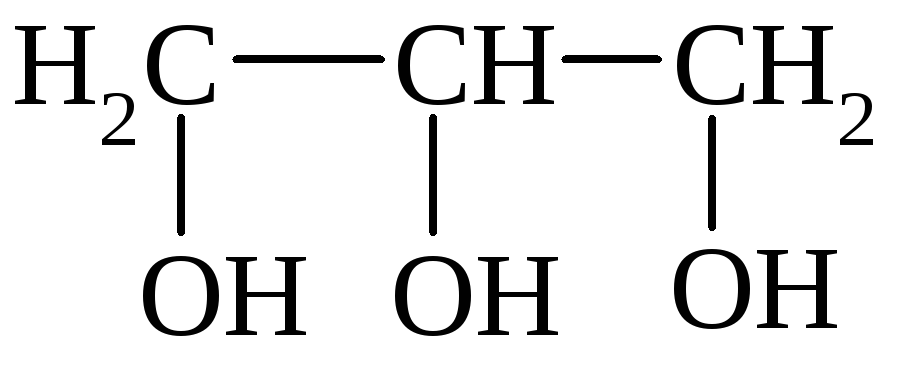
Этанол Этиленгликоль Глицерин
II. По характеру R различают: 1) предельные, 2) непредельные 3) циклические, 4) ароматические.
СН3-СН2-ОН 2) СН2 = СНСН2ОН
Этанол (предельный спирт) пропен-2-ол (непредельный спирт)
3) К непредельным циклическим спиртам относятся:ретинол (витаминА) и холестерин
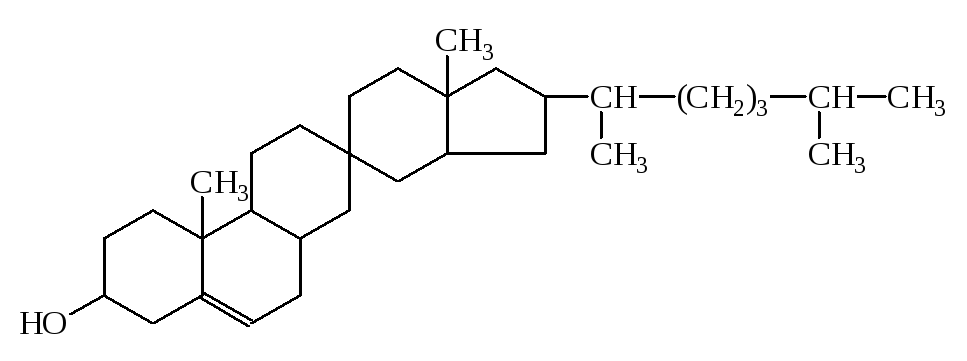 витамин А
витамин А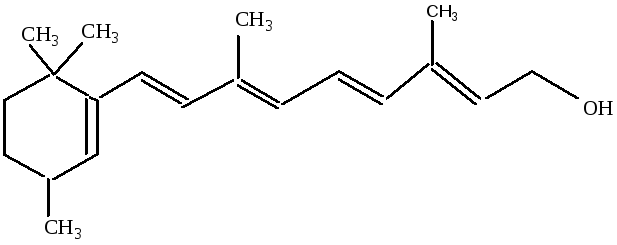
Холестерин
Одноатомные спирты
(корень+окончание «ол»+арабская цифра).
Одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
o первичные R–CH2–OH,
o вторичные R2CH–OH,
o третичные R3C–OH.
Например:
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
o предельные (например, СH3 – CH2–OH)
o непредельные (CH2=CH–CH2–OH)
o ароматические (C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
1. Определение
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула: CnH2n+1OH или ROH или CnH2n+2O |
2. Гомологический ряд
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
4. Изомерия спиртов
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:
· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:
· межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
5. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
6. Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Видео-опыт: Физические свойства спиртов
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
Вывод:
1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
Жиры – ценный химический продукт, один из главных компонентов животных и растительных клеток. Этот урок будет посвящен изучению строения и наиболее характерных свойств жиров.
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».




I. Жиры в природе и их роль
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
II. История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии "Химические исследования тел животного происхождения".
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
III. Синтез жиров

В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.

Общая формула жиров (триглицеридов):

Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.



Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами.
Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.

Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) масляная (C3H7COOH) | В составе животных жиров |
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) | В составе растительных жиров |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
V. Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
- в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
- для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.

На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.

В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Видео-опыт: "Определение непредельности жиров"
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:
- линолевая CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,
- линоленовая CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH,
- арахидоновая CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH
VI. Химические свойства жиров
1. Гидролиз, или омыление
Происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:

или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2. Гидрирование жиров
Это превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

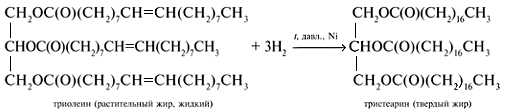
- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка.
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
ЖИРЫ
1. Важнейшими представителями природных сложных эфиров являются жиры.



2.Классификация жиров:
1) твердые – это жиры, в состав которых входят предельные карбоновые кислоты. Это жиры животного происхождения (говяжий, свиной, бараний и т.д.), исключение составляет рыбий жир;
2) жидкие – это жиры, в состав которых входят непредельные карбоновые кислоты. Это жиры растительного происхождения, или масла (подсолнечное масло, соевое масло, рапсовое масло и т.д.), исключение составляет пальмовое масло.
3.. Химические свойства жиров:
А). Жиры нерастворимы в воде, но хорошо растворимы в органических растворителях – бензоле, гексане;
Б). Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения из растительного масла твердого жира – маргарин.

В). Жиры подвергаются гидролизу.

Г). Если проводить гидролиз жиров в щелочной среде, то произойдет омыление жиров.

4. Что такое мыла?
Запись в тетрадь.
Мыла – натриевые или калиевые соли высших карбоновых кислот. Натриевые соли высших карбоновых кислот имеют твердое агрегатное состояние, а калиевые – жидкое (жидкое мыло).
При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.»
Почему мыло теряет свою моющую способность в жесткой воде?
(Если мы используем для мытья и стирки жесткую воду, а такая вода содержит ионы Са 2+ и Mg2+,то мыло теряет свою моющую способность.)
Как вы думаете почему?
(Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. Запишем уравнение реакции:
2С17Н35СООNa + СаСI2 = (C17 H35COO)2Ca ↓ + 2NaCI)
Почему после мытья волос твердым мылом в жесткой воде нужно прополоскать их раствором уксуса?
(Чтобы удалить нерастворимые соли кальция и жирных кислот.)
Как используя мыльный раствор отличить родниковую воду от снеговой? (В родниковой выпадет осадок).
. Тестирование
1 - В результате гидролиза жидкого жира образуются:
1) твердые жиры и глицерин; 3) глицерин и непредельные кислоты;
2) глицерин и предельные кислоты; 4) твердые жиры и смесь кислот.
2 - В каком веществе жиры не растворяются?
1) в бензоле; 3) в воде;
2) в бензине; 4) в хлороформе.
3 - Для превращения жидких жиров в твердые используют реакцию:
1) дегидрогенизации; 3) гидрогенизации;
2) гидратации; 4) дегидроциклизации.
4 - В результате гидрирования жидких жиров образуются:
1) твердые жиры и непредельные кислоты; 3) твердые жиры и глицерин;
2) твердые жиры и предельные кислоты; 4) твердые жиры.
Видео-опыт: "Определение непредельности жиров"












