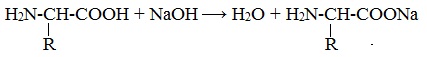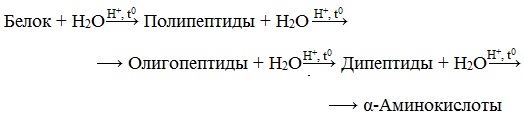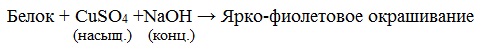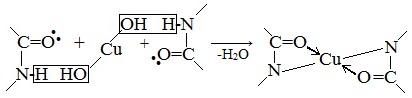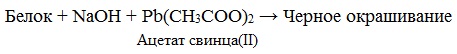ПЯТНИЦА, 04.02.22г. 401, 208, 301 ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен: -соблюдать отведенное время; - разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 ХИМИЯ 32,33
ТЕМА: Практическая работа №1 Приготовление раствора заданной концентрации.
Практическая работа №1.
ТЕМА:Приготовление раствора заданной концентрации.
Цель: - научиться практически готовить растворы с заданной
массовой долей растворённого вещества.
Задачи: - повторить и использовать правила ТБ
-повторить и практически применить знания о растворах
и массовой доле растворённого вещества,
- познакомиться с устройством лабораторных весов и
правилами
взвешивания,
-формировать коммуникативные компетентности.
Оборудование и реактивы:
Весы лабораторные, химические стаканы (V = 50мл),
стеклянные палочки, мензурки (V =50мл), дистиллированная вода, поваренная соль.
Ход работы.
Приготовление растворов солей с определённой массовой
долей растворённого вещества.
Теоретическая часть (закрепление знаний формул для расчетов массовой доли вещества, умение решения задач разных типов)
1.Приготовить 20 г.водного раствора соли массовой долей соли 5%.
2.Какую массу щелочи необходимо взять для приготовления 50 г 16%-ного раствора?
3. К 600 г 50% р-ра соли добавили 100 г воды. Чему равна массовая доля соли в полученном растворе?
Ход работы (Практическая часть)
Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы.
1) Нельзя пробовать вещества на вкус.
2) Нельзя брать вещества руками.
3) Если взяли реактива больше, чем требуется, нельзя высыпать ( выливать) обратно в банку (склянку).
4) Нюхать вещества с осторожностью.
5) Работать аккуратно и внимательно , соблюдая порядок и дисциплину.
6) По окончанию работы привести в порядок рабочее место и вымыть руки с мылом.
Приготовление раствора с определенной массовой долей растворенного вещества. Приготовить раствор хлорида натрия массой
m(NaCl) = 300 · 0,12 = 36 (г);
m(H2O) = 300 - 36 = 264 (г), что соответствует объему 264 мл воды.
В колбу или стакан на 500-700 мл поместим предварительно взвешенную навеску соли массой
Вывод
- Что такое массовая доля растворённого вещества?
- Что говорит о растворе его массовая доля?
ТЕМА: Контрольная работа №2
ГРУППА 208 ХИМИЯ 41,42,43
ВНИМАНИЕ! Экзамен в МАРТЕ!
См. вкладку "Экзамен 208"и "Решаем задачи"и ещё
ТЕМА: Основания органические и неорганические. Основания в свете теории электролитической диссоциации. Основания в свете протолитической теории. Классификация органических и неорганических оснований. Химические свойства щелочей и нерастворимых оснований.
Основания органические и неорганические
Fe(OH)2 ↔ Fe2+ + 2OH—
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH—
R-NH2 + H2O ↔ [R-NH3]+ + OH—
К органическим основаниям относятся амины – производные аммиака, в которых атомы водорода замещены на углеводородные радикалы (R-NH2). Общая формула аминов (предельных) CnH2n+3N.
Классификация оснований
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2).
Амины делятся на первичные, вторичные и третичные в зависимости от того, сколько атомов водорода замещено на радикал. Общая формула первичных аминов – R-NH2, вторичных – R-NH-R’, третичных – R-N(R’) – R’’.
Физические свойства оснований
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Низшие амины хорошо растворяются в воде и имеют резкий запах.
Получение оснований
Органические и неорганические основания получают разными способами, так неорганические основания можно получить по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
— активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑
BaO + H2O→ Ba(OH)2↓
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑
Амины получают путем нагревания алкилгалогенидов с аммиаком (1), либо восстановлением нитросоединений (2):
CH3Cl + NH3 = [CH3NH3]Cl = CH3NH2 (1)
C6H5NO2 + 6[H] = C6H5NH2 + 2H2O
Химические свойства оснований
Общим химическим свойством органических и неорганических оснований является способность взаимодействовать с кислотами:
Cu(OH)2 + H2SO4 = CuSO4 +2H2O
CH3NH2 + H2SO4 =[CH3NH3]HSO4
Специфические свойства неорганических оснований
Неорганические основания способны:
— к термическому разложению при нагревании (нерастворимые в воде)
2Fe(OH)3 = Fe2O3 + 3 H2O
Mg(OH)2 = MgO + H2O
— реакциям с кислотными оксидами (только щелочи)
NaOH + CO2 = NaHCO3
— ОВР щелочей с некоторыми неметаллами
2NaOH + Si + H2O → Na2SiO3 +H2↑
Специфические свойства органических оснований
Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
4C2H5NH2 +15O2 = 8CO2 +2N2 + 14H2O
Примеры решения задач
| Задание | Относительная плотность паров ароматического амина по азоту равна 3,82. Выведите формулу амина. |
| Решение | Найдем молекулярную массу амина: М=d × M(N2) M = 3,82 × 28 = 107 Запишем формулу амина в общем виде и выразим его молекулярную массу: CnH2n-5N M(CnH2n-5N) = 12n + 2n + 5 +15 = 14n+9 14n+9=107 14n=98 N=7 Подставим 7 вместо n в общую формулу амина: С7H9N |
| Ответ | Формула амина — С7H9N |
| Задание | Вычислите практическую массу оксида алюминия (выход целевого продукта составляет 92%) по реакции разложения гидроксида алюминия массой 23,4 г. |
| Решение | Запишем уравнение реакции: 2Al(OH)3 = Al2O3 + 3H2O Найдем количество вещества Al(OH)3 v(Al(OH)3)=m(Al(OH)3)/M(Al(OH)3) v(Al(OH)3)= 23,4/78 =0,3 моль По уравнению реакции: v(Al2O3)=0,5 × v(Al(OH)3) Следовательно, количество вещества Al2O3 v(Al2O3)=0,5 ×0,3 = 0,15 моль Найдем теоретическую массу Al2O3 m(Al2O3)th =0,15×102 = 15,3 г Практическая масса Al2O3 оставляет: m(Al2O3)pr = m(Al2O3)th × 92/100 m(Al2O3)pr = 15,3×0,92 = 14 г |
| Ответ | Практическая масса оксида алюминия 14 г. |
ТЕМА:Амфотерные органические и неорганические соединения. Амфотерные основания в свете протолитической теории. Амфотерность оксидов и гидроксидов переходных металлов: взаимодействие с кислотами и щелочами.
Амфотерные органические и неорганические соединения
К амфотерным неорганическим соединениям относят оксиды и гидроксиды следующих металлов – Al, Zn, Be, Cr (в степени окисления +3) и Ti (в степени окисления +4). Амфотерными органическими соединениями являются аминокислоты – NH2–CH(R)-COOH.
Получение амфотерных соединений
Амфотерные оксиды получают путем реакции горения соответствующего металла в кислороде, например:
2Al + 3/2O2 = Al2O3
Амфотерные гидроксиды получают по реакции обмена между щелочью и солью, содержащий «амфотерный» металл:
ZnSO4 + NaOH = Zn(OH)2 + Na2SO4
Если щелочь присутствует в избытке, то есть вероятность получения комплексного соединения:
ZnSO4 + 4NaOHизб = Na2[Zn(OH)4] + Na2SO4
Органические амфотерные соединения – аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах. В общем виде уравнение реакции будет выглядеть так:
R-CH(Cl)-COOH + NH3 = R-CH(NH3+Cl—) = NH2–CH(R)-COOH
Химические амфотерных соединений
Главным химическим свойством амфотерных соединений является их способность реагировать с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + NaOH+ 3H2O= 2Na[Al(OH)4]
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + NaOH= Na2[Zn(OH)4]
NH2–CH2-COOH + HCl = Cl[NH3–CH2-COOH]
NH2–CH2-COOH + NaOH= NH2–CH2-COONa + H2O
Специфические свойства амфотерных органических соединений
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями:
NH2–CH2-COOH ↔ +H3N–CH2-COO—
Молекулу внутренней соли называют биполярным ионом.
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:
Также для аминокислот характерны все химические свойства карбоновых кислот (по карбоксильной группе) и аминов (по аминогруппе).
Примеры решения задач
| Задание | Осуществите ряд превращений: а) Al → Al(OH)3 → AlCl3 → Na[Al(OH)4]; б) Al → Al2O3 → Na[Al(OH)4] → Al(OH)3 → Al2O3 → Al |
| Решение | a) 2Al +6H2O = 2Al(OH)3 + 3H2↑ Al(OH)3 + 3HCl = AlCl3 + 3H2O AlCl3 + 4NaOHизб = Na[Al(OH)4] + 3NaCl б) 2Al + 3/2O2 = Al2O3 Al2O3 + NaOH+ 3H2O= 2Na[Al(OH)4] 2Na[Al(OH)4] + H2SO4 = 2Al(OH)3 + Na2SO4 + 2H2O 2Al(OH)3 = Al2O3 + 3H2O 2Al2O3 = 4Al +3O2 |
| Задание | Вычислите массу соли, которую можно получить при взаимодействии 150 г 5%-го раствора аминоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-го раствора щелочи для этого потребуется? |
| Решение | Запишем уравнение реакции: NH2–CH2-COOH + NaOH= NH2–CH2-COONa + H2O Вычислим массу кислоты, вступившей в реакцию: m(NH2–CH2-COOH) = ώк—ты×mр—ра m(NH2–CH2-COOH)= 0,05 × 150 = 7,5 г Найдем количество вещества этой кислоты: v(NH2–CH2-COOH)= mк-ты / Мк-ты v(NH2–CH2-COOH)=7,5/75 = 0,1 моль По уравнению: v(NH2–CH2-COOH)= v(NaOH)= v(NH2–CH2-COONa) = 0,1 моль Найдем массу соли, которая образовалась в ходе реакции: m(NH2–CH2-COONa) = 0,1 × 97 = 9,7 г Найдем массу гидроксида натрия: m(NaOH)= 0,1 × 40 = 4 г Найдем массу раствора гидроксида натрия: msolution(NaOH) = 4/0,12 = 33,3 г |
| Ответ | Масса соли 9,7 г и масса раствора щелочи 33,3 г. |
ТЕМА:Соли. Классификация и химические свойства солей. Особенности свойств солей органических и неорганических кислот.
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков.
Соли бывают средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Например: имеем серную кислоту H2SO4. Средние соли этой кислоты будут иметь состав Na2SO4, CaSO4, Al2(SO4)3. Средние соли ортофосфорной кислоты H3PO4: К3PO4, Ca3(PO4)2, AlPO4. Средние соли в водных растворах диссоциируют всегда в одну ступень:
NaCI ® Na+ + CI -
Al2(SO4)3 ® 2AI3+ + 3SO42-.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Кислые соли могут быть образованы только от многоосновных кислот. Хлороводородная кислота HCl кислых солей не имеет. Серная кислота H2SO4 образует кислые соли в состав которых входит анион HSO4-: NaHSO4, Cu(HSO4)2, Fe(HSO4)3. Фосфорная кислота Н3РО4 имеет два типа кислых солей: с анионами Н2РО4-, НРО42-.
Кислые соли диссоциируют ступенчато:
KH2PO4 ® K+ + H2PO4-,
H2PO4- H+ + HPO42-,
HPO42- H+ + PO43-,
Кислые соли чаще всего образуются в избытке кислоты:
Mg(OH)2 + 2H2SO4 Mg(HSO4)2 + 2H2O.
кислая соль
Mg(OH)2 + H2SO4 MgSO4 + 2H2O
средняя соль
Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Они могут быть образованы только многокислотными основаниями. Гидроксиды щелочных металлов основных солей не имеют.
Гидроксиду меди Сu(ОН)2 соответствуют основные соли с катионом СuОН+: CuOHNO3, (CuOH)2SO4, (CuOH)3PO4.
Гидроксид хрома (III) Cr(ОН)3 образует два ряда основных солей с катионами Cr(ОН)2+, CrОН2+:
Cr(OH)2CI,
CrOHCI2,
(Cr(OH)2)2SO4,
CrOHSO4,
(Cr(OH)2)3PO4,
(CrOH)3(PO4)2.
Основные соли диссоциируют ступенчато:
CuOHNO3 ® CuOH+ + NO3- (первая ступень),
CuOH+ Cu2+ + OH- (вторая ступень).
Основные соли образуются в избытке основания:
2Cu(OH)2 + H2SO4 (CuOH)2SO4 + 2H2O
основная соль
Cu(OH)2 + H2SO4 CuSO4 + 2H2O
средняя соль
Номенклатура солей:
1. Средние соли бескислородных кислот.
Название данных солей образуется следующим образом.
В начале называется анион, названия одноатомных анионов образуются из корней латинских названий соответствующих элементов с суффиксом «ид» (Cl - – хлорид, F - – фторид, S2- – сульфид), затем называется катион. Одноатомные катионы обозначаются русским названием элемента в родительном падеже. Если элемент имеет переменную валентность, то она указывается в названии. Например:
NaCl – хлорид натрия;
Са3Р2 – фосфид кальция;
Fe2S3 – сульфид железа (III).
2. Средние соли кислородсодержащих кислот.
Названия анионов кислородосодержащих кислот составляются из корня латинского названия элемента, образующего кислоту, с добавлением суффиксов: «ат» (когда кислотообразующий элемент проявляет высшую степень окисления):
+6 +5
(SO4)2- – сульфат, (NO3)- – нитрат;
«ит» (когда кислотообразующий элемент проявляет низшую степень окисления):
+4 +3
(SO3)2- – сульфит, (NO2)- – нитрит.

+6
Na2SO4 – сульфат натрия;
+5
К3 РО4 – фосфат калия;
+2 +5
Cu(NO3)2 - нитрат меди (II);
+1 +5
CuNO3 - нитрат меди (I);
+4
CaSO3 - сульфит кальция;
+3
AI(NO2)3 - нитрит алюминия;
+2
Fe(NO2)2 - нитрит железа (II).
Если данный кислотообразующий элемент образует кислоты более, чем в двух степенях окисления, то суффикс «ат» применяется во всех названиях атомов кислот, русские названия которых содержат суффиксы «оватая», «овая» и «ная». При этом к названию аниона, в котором кислотообразующий элемент имеет высшую степень окисления добавляется приставка «пер». Так, анион хлорноватой кислоты:
+5
ClО3- – называется хлорат-ион, а анион хлорной кислоты:
+7
ClО4- – перхлорат-ион.
В названиях анионов кислот, русские названия которых содержат суффиксы «оватистая» и «истая», используется суффикс «ит». К названию же аниона, в котором кислотообразующий элемент имеет низшую степень окисления, добавляется приставка «гипо». Так, анион хлористой кислоты ClO2- – называется хлорит-ион, а хлорноватистый ClO-– гипохлорит-ион.
Кислородосодержащие кислоты хлора | СОЛИ |
HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
HClO4 – хлорная кислота | KClO4 – перхлорат калия |
Если в названии кислоты используются приставки «мета», «орто» и другие, то и в названии соли они сохраняются: НРО3 – метафосфорная кислота, КРО3 – метафосфат калия,
H3PO4 - ортофосфорная кислота, K3PO4 - ортофосфат калия.
В названиях анионов кислых солей с одним атомом водорода содержится приставка «гидро» (от латинского названия водорода Hydrogenium – гидрогениум). Если же в кислотном остатке несколько атомов водорода, то в названии кислой соли сохраняется приставка «гидро», но с греческим числительным, показывающим число атомов водорода в анионе:
NaHSO4 – гидросульфат натрия;
Са(НСО3)2 – гидрокарбонат кальция;
FeНРО4 – гидрофосфат железа (II);
КН2РО4 – дигидрофосфат калия;
Fe(Н2РО4)3 – дигидрофосфат железа (Ш).
В состав катионов основных солей входят катион соответствующего металла и группа ОН-, которой дано сложное название, состоящее из корня латинского названия водорода «гидро» и слова «оксид»: гидроксид – ион, или гидроксо – «группа». Причем в названиях сдвоенные буквы «О» превращаются в одну. Число ОН- – групп в сложном катионе указывается греческим числительным:
ZnOHCl – хлорид гидроксоцинка;
FeOHSO4 – сульфат гидроксожелеза (III);
[Al(OH)2]2SO4 – сульфат дигидроксоалюминия;
SnOHNO3 – нитрат гидроксоолова (II).
При составлении формул придерживаются следующих правил:
по суффиксу в названии средней соли определяют какой кислоты соль: бескислородной или кислородсодержащей.
Например:
1. Хлорид натрия: «ид» показывает, что это соль бескислородной кислоты с анионом Cl-. Катионом является Na+. Записываем сначала катион, затем анион Na+Cl-. Катион и анион однозарядны, индексы не используются.
2. Сульфид алюминия: Al3+S2- истинная формула Al2S3, молекула электронейтральна.
3. Сульфат железа (III): «ат» показывает, что это соль кислородсодержащей кислоты, в которой сера в максимальной степени окисления. Это анион SO42-. Катион железа – Fe3+. Записываем сначала катион и анион, а затем индексы, выравнивающие число положительных и отрицательных зарядов: Fe3+(SO4)2- - истинная формула Fe2(SO4)3.
По названию кислой соли определяют, какой кислоты соль (бескислородной или кислородсодержащей) и сколько атомов водорода входит в состав сложного атома. Далее поступают как при составлении формул средних солей.
Например:
1. Гидросульфид железа (III). Соль бескислородной сероводородной кислоты. Анион содержит один атом водорода НS- , катион Fe2+. Записываем катион, сложный анион и индексы: Fe2+(HS)-, следовательно формула будет Fe(HS)2.
2. Дигидрофосфат кальция. Соль кислородсодержащей фос-форной кислоты. Сложный анион содержит два («ди») атома водорода, катион Са2+. Записываем Са2+(Н2РО4)-. Ставим индексы: Са(Н2РО4)2. Молекула электронейтральна.
По названию основной соли определяют, какой кислоты данная соль и сколько гидроксогрупп входит в состав сложного катиона. Записывают сложный катион, затем анион и индексы, уравнивающие заряды. Если металл имеет переменную валентность, то она указывается в названии соли. Например:
1. Хлорид гидроксотитана (IV),
(ТiОН)3+Cl - – правильная формула TiOHCl3.
2. Нитрат дигидроксокобальта (III)
(Сo(OH)2)+NO3- – правильная формула Сo(OH)2NO3.
Классификация солей по следующим признакам:
1. По растворимости:
рстворимые – KCI, Ba(NO3)2, CuSO4,
нерастворимые– BaSO4, AgCI, Ca3(PO4)2.
2.По свойствам:
cредние или нормальные – Na2SO4, MgCI2,
кислые – KHSO4, Ca(H2PO4)2,
основные – CuOHCI, AI(OH)2NO3.
Получение
1. Взаимодействие металла с неметаллом:
Fe + FeS
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот:
Zn + H2SO4 ZnSO4 + H2
3. Взаимодействие металлов с растворами солей:
Fe + CuSO4 FeSO4 + Cu.
4. Взаимодействие кислот с основаниями (реакция нейтрализации):
HCI + NaOH NaCI + H2O.
5. Взаимодействие кислот с основными оксидами:
H2SO4 + CaO CaSO4 + H2O.
6. Взаимодействие кислот с растворами солей:
H2SO4 + BaCI2 BaSO4
+ 2HCI.
7. Взаимодействие оснований с растворами солей:
2NaOH + CuSO4 Cu(OH)2
+ Na2SO4.
8. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 CaCO3
+ H2O.
9. Взаимодействие основных оксидов с кислотами:
CaO + CO2 CaCO3
10. Взаимодействие растворов солей с неметаллами:
2KBr + CI2 2KCI + Br2.
11. Взаимодействие растворов солей между собой:
NaCI + AgNO3 AgCI
+ NaNO3.
12. Получение солей аммония:
NH3 + HCI NH4CI.
Химические свойства
1. Растворы солей взаимодействуют с металлами, расположенными в ряду напряжений левее, чем металл, входящий в состав соли:
Zn + FeSO4 ZnSO4 + Fe.
2.Растворимые в воде соли взаимодействуют с основаниями:
CuSO4 + 2NaOH Cu(OH)2
+ Na2SO4,
KHSO4 + KOH K2SO4 + H2O.
3. Соли взаимодействуют с растворами кислот:
CaCI2 + H2SO4 CaSO4
+ 2HCI,
Ca(HCO3)2 + 2HCI CaCI2 + H2O + CO2
MgOHCI + HCI MgCI2 + H2O.
4.Водные растворы солей взаимодействуют между собой с образованием новых солей:
BaCI2 + Na2SO4 BaSO4
+ 2NaCI,
Ca(HCO3)2 + Na2CO3 CaCO3
+ 2NaHCO3.
5. Растворы солей взаимодействуют с неметаллами:
2NaI + Br2 2NaBr + I2
6. Многие соли при нагревании разлагаются, особенно
легко – карбонаты:
CaCO3 CaO + CO2
(CuOH)2CO3 CuO + CO2
+ H2O,
2NaHCO3 Na2CO3 + CO2
+ H2O.
7. Некоторые соли взаимодействуют с водой с образованием кристаллогидратов:
CuSO4 + 5H2O ® CuSO4 . 5 Н2О.
белый цвет голубой цвет
Основные классы неорганических соединений связаны между собой. Генетической связью между ними считают тот факт, что из неорганических соединений одного класса можно получить соединение другого класса. Иногда это можно сделать в одну стадию, иногда – в несколько:
Соли карбоновых кислот
При замене протона карбоксильной группы на катион металла или незамещенного или замещенного аммония получаются соли карбоновых кислот:

Методы получения солей
Обладая кислотным характером, карбоновые кислоты легко образуют соли при действии металлов, их гидроксидов и карбонатов или при действии аммиака и аминов:

Натриевые и калиевые соли жирных кислот с большой относительной молекулярной массой (обычно 16-18 атомов углерода в молекуле) в значительных количествах применяются в качестве основы чистящих и моющих средств или детергентов, которые в дан-ном случае называются мылами. Натриевые соли - твердые (ядровые мыла), а калиевые - полутвердые (полужидкие мыла). Основное сырье для производства мыл - животный жир и растительное масло, представляющие собой сложные эфиры глицерина и высших насыщенных и ненасыщенных карбоновых кислот. При нагревании их с гидроксидом натрия образуется густой раствор, содержащий глицерин и соли жирных кислот. Затем к еще горячей жидкости прибавляют поваренную соль - «высаливают» натриевое мыло:

При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот. Эти соли превращают в соответсвующие карбоновые кислоты действием более сильной кислоты, чем получаемая карбоновая кислота. Часто для этого используют соляную кислоту.
ГРУППА 301 ХИМИЯ 49, 50
ТЕМА: Химические свойства белков: горение, денатурация, гидролиз, цветные реакции. Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Изучение свойств белков.
ТЕМА: Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Химические свойства глюкозы, сахарозы, крахмала. Изучение свойств белков.
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
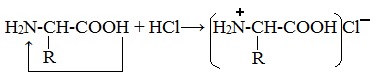
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
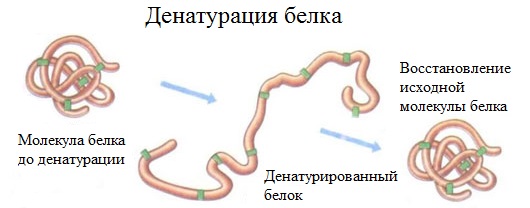
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: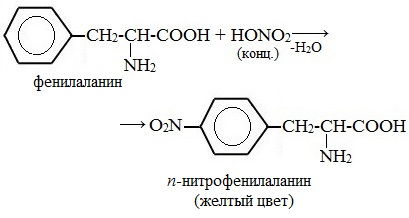
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом: 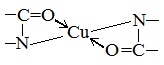
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»