ПОНЕДЕЛЬНИК 05.09.22 Г.
Здравствуйте, уважаемые студенты, заведите, пожалуйста тетрадь для конспектов по химии, другую- по биологии, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 1,2
ТЕМА: Научные методы познания веществ и химических явлений. Роль эксперимента и теории в химии. Моделирование химических процессов.
Прежде чем приступить к любой работе и получить определённый результат, человек выбирает наиболее эффективные и доступные способы и приёмы выполнения её, инструмент и приспособления, которые можно использовать для этого, операции, которые необходимо совершить.
Совокупность приёмов и операций практического и теоретического освоения действительности и определяет понятие «метод».
Рассмотрим научные методы познания химии, т.е. методы познания, которые используются для изучения веществ и химических явлений.
Различают 2 уровня научного познания: эмпирический и теоретический.
Методы эмпирического уровня познания
Эмпирический уровень - характеризуется исследованием реально существующих объектов. На этом уровне происходит процесс накопления информации об этих объектах с помощью следующих методов: наблюдение, измерение, постановка экспериментов.
В это же время осуществляется первичная систематизация получаемых фактических данных в виде описания, таблиц, схем, графиков и т.д.
Познакомимся с каждым из этих методов отдельно.
Наблюдение – это первоначальный метод эмпирического познания, позволяющий получить первичную информацию об объекте изучения.
Наблюдение является целенаправленным, планомерным, активным методом научного познания: оно ведётся для решения заранее поставленных задач, строго по составленному исследователем плану, согласованному с поставленными задачами и сопровождается активными действиями исследователя. Результаты научных наблюдений фиксируются в виде описания признаков наблюдаемого объекта, таблиц, схем и т.д. Всё это является базисом науки, опираясь на который учёные создают эмпирические обобщения, сравнивают изучаемые объекты по тем или иным признакам, проводят классификацию, выявляют закономерности.
Наблюдения могут быть непосредственными, воспринимаемыми органами чувств человека, и опосредованными, которые проводятся с использованием технических средств наблюдения: микроскопов, телескопов и др.
В процессе наблюдения могут совершаться открытия новых явлений, позволяющих обосновать какую-либо научную гипотезу или подтвердить какое-либо положение известной теории.
Из всего сказанного следует, что наблюдение является важнейшим методом научного познания, позволяющим собрать обширную информацию об окружающем мире.
Эксперимент – более сложный метод эмпирического познания по сравнению с наблюдением. Он отличается от метода наблюдения тем, что в ходе эксперимента исследователь может изменять условия (давление, температуру, напряжение и т.д.), устранять побочные факторы, затрудняющие процесс исследования. Эксперимент может повторяться несколько раз для получения наиболее достоверных результатов.
Условия научного эксперимента: целенаправленность, наличие базы в виде исходных теоретических положений, наличие плана проведения эксперимента, наличие технических средств, наличие специалистов необходимого уровня квалификации.
В зависимости от характера поставленных задач, решаемых в ходе эксперимента, последние подразделяются на исследовательские и проверочные.
Исследовательские эксперименты направлены на обнаружение новых, неизвестных науке свойств изучаемого объекта. Результатом такого эксперимента могут быть выводы, изменяющие представления об этом объекте.
Проверочные эксперименты служат для проверки или подтверждения тех или иных теоретических положений.
Следующий эмпирический метод познания – измерение.
Измерение – это процесс определения количественных значений свойств изучаемого объекта с помощью специальных технических устройств.
Измерения бывают прямые и косвенные.
Прямые измерения – это такие измерения, при которых значение измеряемой величины выдаётся непосредственно измерительным прибором.
При косвенном измерении искомое значение величины определяют по известной математической зависимости (по формуле), используя для этого данные, полученные при прямых измерениях.
В процессе измерения не всегда требуется участие человека. Измерение может быть включено в работу автоматической информационно-измерительной системы, которая строится на базе электронно-вычислительной техники.
Методы теоретического уровня познания
Идеализация – представляет собой мысленное внесение определенных изменений в изучаемый объект в соответствии с целями исследований. В результате таких изменений могут быть исключены из рассмотрения какие-то свойства, признаки, стороны объектов. Например, в механике идеализация материальной точки как тела, лишенного размеров и массы. Такой прием удобен при описании движения, в том числе атомов и молекул.
Идеализация используется тогда, когда реальные объекты достаточно сложны для имеющихся средств математического анализа, когда некоторые свойства затемняют существо протекающих в объекте процессов.
Роль идеализации как метода научного познания заключается в том, что получаемые на его основе теоретические положения, можно использовать для исследования реальных объектов или явлений.
Формализация - заключается в использовании специальной символики, позволяет отвлечься от изучения реальных объектов и оперировать вместо этого символами (знаками). Достоинством формализации является возможность проведения исследований без обращения к какому-либо объекту, кроме этого обеспечивается краткость и четкость записи научной информации.
Методы, применяемые на эмпирическом и теоретическом уровнях познания
Анализ и синтез.
Под анализом понимают разделение объекта (мысленно или реально) на составные части с целью изучения их по отдельности.
Под синтезом понимают соединение составных частей объекта (мысленно или реально) с целью изучения его как единого целого. Для изучения объекта как единого целого необходимо рассматривать его составные части в совокупности, в единстве. В процессе синтеза производится соединение воедино составных частей изучаемого объекта. Анализ и синтез успешно используются в сфере мыслительной деятельности человека, т.е. в теоретическом познании.
Моделирование – основано на изучении моделированного объекта. Модель строится по подобию оригинала, на ней воспроизводят, свойственные оригиналу процессы и полученные сведения переносятся на моделируемый объект – оригинал.
Различают несколько видов моделирования:
Мысленное. К нему относятся самые различные мыслительные представления в форме тех или иных воображаемых моделей.
Физическое. Оно характеризуется физическим подобием между моделью и оригиналом.
Символическое – связано с построением графиков, схем.
Численное моделирование на ЭВМ.
Моделирование как метод познания бывает единственно необходимым для исследования некоторых явлений.
Таким образом, все названные методы научного познания являются важными и необходимыми для познания окружающего мира.
ТЕМА 2. Основные понятия химии. Вещество. Атом. Молекула. Химический элемент. Аллотропия. Простые и сложные вещества. Качественный и количественный состав веществ.
1.Вещество. Атом. Молекула. Химический элемент. Аллотропия.
Химия– это наука о веществах и процессах их превращения, при которых происходит изменение состава и структуры.
Вещество - это каждый отдельный вид материи, обладающий при данных условиях определенными физическими свойствами (вода, железо, сера, известь, кислород). Природные вещества представляют собой смеси, состоящие иногда из большого числа различных веществ.
Основой всей химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон Д.И.Менделеева и теория химического строения.
Создание атомно-молекулярного учения относится к концу 18 - началу 19 вв., когда в химию были введены количественные методы исследования.
Огромный вклад в создание этой теории внес русский ученый М.В.Ломоносов.
Основные положения заключаются в следующем:
1. Вещества состоят из молекул; молекулы различных веществ отличаются между собой химическим составом, размерами, физическими и химическими свойствами.
2. Молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния веществ.
3. При физических явлениях состав молекул остается неизменным, при химических - претерпевают качественные и количественные изменения и из одних молекул образуются другие.
4. Молекулы состоят из атомов. Атомы характеризуются определенными размерами и массой. Свойства атомов одного и того же элемента одинаковы и отличаются от свойств атомов других элементов.
При химических реакциях атомы не претерпевают качественных изменений.
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента, предел химической делимости материи. Атом- носитель свойств химического элемента.
Атомы могут взаимодействовать между собой, образуя молекулы.
Валентность – это способность атомов элементов образовывать химические связи. Молекула – это система, состоящая из связанных между собой атомов.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекула способная к самостоятельному существованию и состоит из одинаковых или различных атомов, соединенных в одно целое химическими связями.
Химический элемент – это совокупность атомов с одинаковым положительным зарядом ядра.
Каждый химический элемент обозначают соответствующим символом. Символ Cu обозначает атом меди, H- один атом водорода.
Состав веществ обозначают химическими формулами, в которых символами указывают химические элементы, входящие в состав вещества, цифровыми индексами справа – число атомов каждого элемента. В состав молекулы серной кислоты H2SO4 входят два атома водорода, один атом серы и четыре атома кислорода.
Каждая химическая связь в формуле обозначается черточкой.
Способность химического элемента образовывать несколько простых веществ называется аллотропией.
А различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями.
Явление аллотропии обусловлено несколькими причинами:
- Образованием молекул с различным числом атомов (кислород О2 и озон О3 фосфор двухатомный Р 2 и четырехатомный Р4)
- образованием кристаллов различных модификаций (углерод в виде графита и алмаза).
2. Простые и сложные вещества. Качественный и количественный состав веществ.
Простые вещества – это вещества, образованные одним химическим элементом.
Один и тот же химический элемент может образовывать несколько простых веществ.
Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
Различают в качественный и количественный состав веществ.
Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество.
Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Состав веществ отображают посредством химической символики.
Контрольные вопросы:
1.Какая связь между понятием «атом» и «молекула»? В чем различие между ними?
2.Чем отличается простое вещество от химического элемента?
ГРУППА 408 ХИМИЯ 1,2
ТЕМА:Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение.
 Содержание
Содержание
- Этиленгликоль
спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Наиболее широко известны два многоатомных спирта — этиленгликоль и глицерин. Рассмотрим свойства этих спиртов.
 Этиленгликоль
Этиленгликоль
 Физические свойства этиленгликоля
Физические свойства этиленгликоля
Этиленгликоль (тривиальное название), или этандиол (систематическое название). Химическая формула

Этиленгликоль
Этиленгликоль — двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество, температура вспышки его паров
 Химические свойства этиленгликоля
Химические свойства этиленгликоля
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие со щелочными металлами
При взаимодействии этиленгликоля с щелочными металлами образуются соли — гликоляты. При этом этиленгликоль сначала образуется моноалкоголят, а затем — динатриевое производное:

2. Взаимодействие с органическими кислотами
В результате взаимодействия этиленгликоля с органическими кислотами образуются одно- и двухзамещенные сложные эфиры (аналогично глицерину):
3. Взаимодействие с галогеноводородами
Этиленгликоль взаимодействует с галогеноводородами, образуя этиленгалогенгидрины:
4. Дегидратация
При нагревании этиленгликоля в присутствии концентрированной серной кислоты возможно образование ацетальдегида:
В результате дегидратации возможно также образование циклического простого эфира — диоксана:

5. Качественная реакция на этиленгликоль
Качественной реакцией на многоатомные спирты является образование ярко-синего раствора при взаимодействии с гидроксидом меди(

 Применение этиленгликоля
Применение этиленгликоля
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
 Получение этиленгликоля
Получение этиленгликоля
В промышленности этиленгликоль получают путём гидратации оксида этилена при повышенном давлении и температуре в присутствии

Этиленгликоль может быть также получен окислением этилена перманганатом калия в нейтральной или слабощелочной среде:
ТЕМА: Строение, свойства и применение фенола.
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд феноло
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода. Отличия:
|
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода. |
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
ГРУППА 308 ХИМИЯ 1
ТЕМА: Дисперсные системы.
Тема: Дисперсные системы. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
Дисперсные системы
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению истинных растворов и дисперсных систем: способам выражения концентрации растворов, видам дисперсных систем, их свойствам, способам коагуляции золей, строению гелей.
Глоссарий
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10-3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10-3 см.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10-7 – 10-5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10-3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Истинные растворы
Истинным раствором называется гомогенная система, состоящая из нескольких компонентов, состав которой в определённых пределах можно менять без нарушения однородности.
Растворимостью называется такое количество вещества, которое можно при данной температуре растворить в 100 г растворителя. Абсолютно нерастворимых веществ в природе не существует.
Дисперсные системы
Дисперсной называется гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена во второй, сплошной фазе. В отличие от истинных растворов, дисперсная система неоднородна, а между составляющими её фазами всегда существует граница раздела. Мелкораздробленная фаза называется дисперсной фазой, а сплошная фаза – дисперсионной средой. В зависимости от размера частиц дисперсной фазы различают грубодисперсные (размер частиц больше 100 нм) и тонкодисперсные (от 1 до 100 нм), или коллоидные системы. Если размер частиц дисперсной фазы становится меньше 1 нм, система перестает быть гетерогенной, образуется истинный раствор. В истинном растворе вещество раздроблено до отдельных молекул или ионов. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на суспензии, эмульсии, пены и аэрозоли. В суспензии твёрдые частицы распределены в жидкости. Эмульсия состоит из мелких капель жидкости, равномерно распределённых в другой жидкости, причем эти жидкости взаимно нерастворимы. Пена – это мелкие пузырьки газа в жидкости. Аэрозоль представляет собой газообразную среду, в которой распылены мелкие твёрдые или жидкие частицы.
Получение и свойства коллоидных растворов
Тонкодисперсные коллоидные системы получили название «золь». Золи могут быть образованы как неорганическими веществами, так и органическими макромолекулами, размеры которых превышают 1 нм, например, белками. Приготовить золь можно смешиванием малорастворимого вещества с растворителем (раствор крахмала, яичного белка), так и с помощью химических реакций ионного обмена, гидролиза, окисления-восстановления, в которых один из продуктов реакции не растворяется в жидкости.
Золи прозрачны, как и истинные растворы. Чтобы отличить золь от истинного раствора, надо посмотреть на проходящий через раствор луч в отражённом свете. В коллоидном растворе свет рассеивается, образуя светлый конус. Это явление получило название «эффект Тиндаля» - по фамилии английского физика Джона Тиндаля, который впервые описал и объяснил это явление. С древних времён люди ценили драгоценный камень опал за игру света. Его окраска в зависимости от угла зрения изменяется с голубой на желтоватую. Опал – это затвердевший коллоидный раствор, а свойство золей изменять окраску в проходящем и отражённом свете получило название «опалесценция».
ГРУППА 403 ХИМИЯ 1,2
ТЕМА: Диены и каучуки. Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
ТЕМА: Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки .
| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 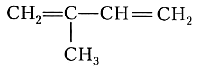
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 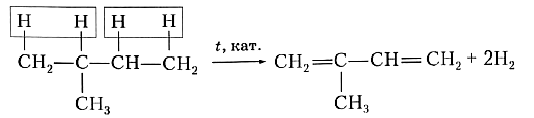
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 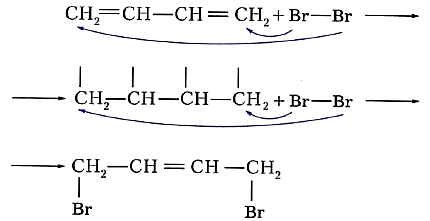
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 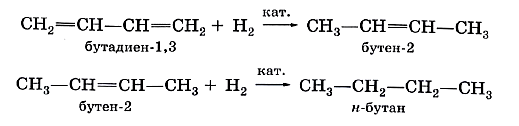
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 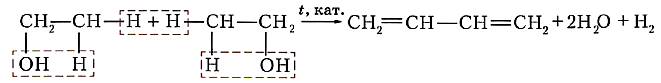
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
















