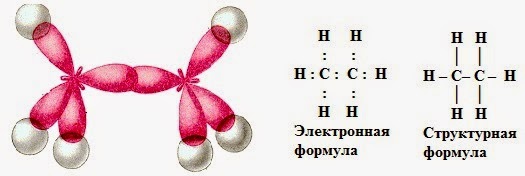30.09.22 г. Пятница. Гр.308, 405, 508,401
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 308 химия 12,13
Тема 12: Производство серной кислоты контактным способом.
Производство серной кислоты контактным способом
“Едва ли найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов для ее добывания - немыслимо выгодное производство многих других веществ, имеющих важное технические значение” Д.И. Менделеев Серная кислота применяется в разнообразных производствах химической промышленности:
Производство серной кислоты Серную кислоту в промышленности производят двумя способами: контактным и нитрозным. Контактный способ производства серной кислоты Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах. В настоящее время основным методом производства серной кислоты является контактный, т.к. этот метод имеет преимущества перед другими: - получение продукта в виде чистой концентрированной кислоты, приемлемой для всех потребителей; - уменьшение выбросов вредных веществ в атмосферу с выхлопными газамиI. Сырьё, используемое для производства серной кислоты. Основное сырьё сера - S серный колчедан (пирит) - FeS2 сульфиды цветных металлов - Cu2S, ZnS, PbS сероводород – H2S Вспомогательный материал катализатор - оксид ванадия – V2O5 II. Подготовка сырья. Разберём производство серной кислоты из пирита FeS2. 1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ. 2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют. III. Основные химические процессы: 4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q или сжигание серы S + O2 t °C→ SO2 2SO2 + O2 400-500°С,V2O5,p↔2SO3 + Q SO3 + H2O → H2SO4 + Q IV. Технологические принципы: - принцип непрерывности; - принцип комплексного использования сырья, использование отходов другого производства; - принцип безотходного производства; - принцип теплообмена; - принцип противотока (“кипящий слой”); - принцип автоматизации и механизации производственных процессов. V. Технологические процессы: Принцип непрерывности: обжиг пирита в печи →поступление оксида серы (IV) и кислорода в очистительную систему →в контактный аппарат →подача оксида серы (VI) в поглотительную башню. VI. Охрана окружающей среды: 1) герметичность трубопроводов и аппаратуры 2) газоочистительные фильтры VII. Химизм производства:КАРТА- СХЕМА ПРОИЗВОДСТВА СЕРНОЙ КИСЛОТЫ I. Сырьё: сера - S серный колчедан (пирит) - FeS2 сульфиды цветных металлов - Cu2S, ZnS, PbS сероводород – H2S II. Вспомогательный материал катализатор- оксид ванадия – V2O5 III. Основные химические процессы: 4FeS2 + 1102→ 8SO2 + 2Fe2O3 кат. 2 SO2 + O2 →2SO3 + Q SO3 + H2O → H2SO4 + Q IV. Технологические принципы: 1) Принцип непрерывности 2) Принцип теплообмена 3) Принцип противотока 4) Принцип безотходного производства V. Технологические процессы: обжиг пирита в печи →поступление оксида серы (IV) и кислорода в очистительную систему →в контактный аппарат →подача оксида серы (VI) в поглотительную башню. VI. Охрана окружающей среды: 1) герметичность трубопроводов и аппаратуры 2) газоочистительные фильтры ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое". Для получения серной кислоты используют, в основном, флотационный колчедан - отход производства при обогащении медных руд, содержащих смеси сернистых соединений меди и железа. Процесс обогащения этих руд происходит на Норильской и Талнахской обогатительных фабриках, которые и являются основными поставщиками сырья. Это сырье является более выгодным, т.к. серный колчедан добывают, в основном, на Урале, и, естественно, доставка его может быть очень дорогостоящей. Возможно использование серы, которая также образуется при обогащении руд цветных металлов, добываемых на рудниках. Поставщиками серы являются также ТОФ и НОФ. (обогатительные фабрики). Уравнение реакции первой стадии 4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета. В “кипящем слое” не слеживаются даже самые мелкие частицы пирита. Поэтому процесс обжига происходит очень быстро. Если раньше для обжига пирита требовалось 5-6 часов, то теперь - всего несколько секунд. Притом, в “кипящем слое” можно поддерживать температуру 800°С. За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений. Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве). Таким образом, выполняется принцип химического производства - безотходность производства. Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды. Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз). Для удаления мелких частиц смесь направляем в электрофильтры, где идет очищение под действием тока высокого напряжения ~ 60000 В (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду. Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. Для увеличения поверхности соприкосновения газа и жидкости башню заполняют керамическими кольцами. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2. ВТОРАЯ СТАДИЯ – каталитическое окисление SO2 в SO3 кислородом в контактном аппарате. Уравнение реакции этой стадии: 2SO2 + O2 400-500°С,V2O5,p ↔2SO3 + Q Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3). Из уравнения следует, что реакция обратимая, а, значит, на этой стадии необходимо поддерживать такие условия, чтобы равновесие смещалось в сторону выхода SO3, иначе нарушится весь процесс. Т.к. реакция идет с уменьшением объема (3V↔2V), то необходимо повышенное давление. Повышают давление до 7-12 атмосфер. Реакция экзотермическая, поэтому, учитывая принцип Ле-Шателье, при высокой температуре этот процесс вести нельзя, т.к. равновесие сдвинется влево. Начинается реакция при температуре = 420 градусов, но благодаря многослойности катализатора (5 слоев), мы можем ее повышать до 550 градусов, что значительно ускоряет процесс. Катализатор используют ванадиевый (V2O5). Он дешевый, долго служит (5-6 лет), т.к. наиболее устойчив к действию ядовитых примесей. Кроме того, он способствует сдвигу равновесия вправо. Смесь (SO2 и O2) нагревается в теплообменнике и движется по трубам, между которыми в противоположном направлении проходит холодная смесь, которую надо нагреть. В результате происходит теплообмен: исходные вещества нагреваются, а продукты реакции охлаждаются до нужных температур. ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой в поглотительной башне. А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O →H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Уравнение реакции этого процесса: nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. Использованы материалы: http://festival.1september.ru/articles/419574/ |
Тема 13: Электролитическая диссоциация. Сильные и слабые электролиты. Среда водных растворов. Водородный показатель (рН) раствора.
Степень электролитической диссоциации.
еорию электролитической диссоциации предложил шведский ученый С. Аррениус в 1887 году.
Электролитическая диссоциация – это распад молекул электролита с образованием в растворе положительно заряженных (катионов) и отрицательно заряженных (анионов) ионов.
Например, уксусная кислота диссоциирует так в водном растворе:
CH3COOH⇄H++CH3COO-.
Диссоциация относиться к обратимым процессам. Но различные электролиты диссоциируют по-разному. Степень зависит от природы электролита, его концентрации, природы растворителя, внешних условий (температуры, давления).
Степень диссоциации α – отношение числа молекул, распавшихся на ионы, к общему числу молекул:
α=v´(x)/v(x).
Степень может варьироваться от 0 до 1 (от отсутствия диссоциации до ее полного завершения). Обозначается в процентах. Определяется экспериментальным путем. При диссоциации электролита происходит увеличение числа частиц в растворе. Степень диссоциации показывает силу электролита.
Различают сильные и слабые электролиты.
Сильные электролиты – это те электролиты, степень диссоциации которой превышает 30%.
Электролиты средней силы – это те, степень диссоциации которой делит в пределах от 3% до 30%.
Слабые электролиты – степень диссоциации в водном 0,1 М растворе меньше 3%.
Примеры слабых и сильных электролитов.
Сильные электролиты | Слабые электролиты |
Практически все соли и кислоты: HBr, KOH, NaOH, Ca(OH)2, HNO3, HClO4. | Большинство кислот и оснований: H2S. H2CO3. Al(OH)3, NH4OH. |
Сильные электролиты в разбавленных растворах нацело распадаются на ионы, т.е. α = 1. Но эксперименты показывают, что диссоциация не может быть равна 1, она имеет приближенное значение, но не равна 1. Это не истинная диссоциация, а кажущаяся.
Например, пусть у некоторого соединения α = 0,7. Т.е. по теории Аррениуса в растворе «плавает» 30% непродиссоцииовавших молекул. А 70% образовали свободные ионы. А электролстатическая теория дает другое определение этому понятию: если α = 0,7, то все молекулы диссоциированы на ионы, но ионы свободны лишь на 70%, а оставшиеся 30% - связаны электростатическими взаимодействиями.
КАЖУЩАЯСЯ СТЕПЕНЬ ДИССОЦИАЦИИ.

Степень диссоциации зависит не только от природы растворителя и растворяемого вещества, но и от концентрации раствора и температуры.
Уравнение диссоциации можно представить в следующем виде:
AK ⇄ A- + K+.
И степень диссоциации можно выразить так:

С увеличением концентрации раствора степень диссоциации электролита падает. Т.е. значения степени для конкретного электролита не является величиной постоянной.
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью.
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Сl—, отрицательные полюсы — к положительным ионам Na+ .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O.
Для простоты в химических уравнениях ионы изображают без молекул воды: Н+ , Ag+, Mg2 +, F—, SO42- и т. д.
Источник: https://himya.ru/elektroliticheskaya-dissociaciya.html
ГРУППА 405 химия 17,18
ТЕМА17:Реакции замещения. Реакции изомеризации
ТЕМА 18:Алканы. Алканы: гомологический ряд, изомерия и номенклатура алканов.
Алканы. Строение, номенклатура.
1. Алканы – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
2. Общая формула алканов – СnH2n+2
В таблице представлены некоторые представители ряда алканов и их радикалы.
Формула | Название | Название радикала |
CH4 | метан | - CH3 метил |
C2H6 | этан | - C2H5 этил |
C3H8 | пропан | - C3H7 пропил |
C4H10 | бутан | - C4H9 бутил |
C4H10 | изобутан | изобутил |
C5H12 | пентан | пентил |
C5H12 | изопентан | изопентил |
C5H12 | неопентан | неопентил |
C6H14 | гексан | гексил |
C7H16 | гептан | гептил |
C10H22 | декан | децил |
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)
3. Строение:
Основные характеристики:
пространственное строение – тетраэдрическое
sp3 – гибридизация,
‹ HCH = 109 ° 28
Углеродная цепь - зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана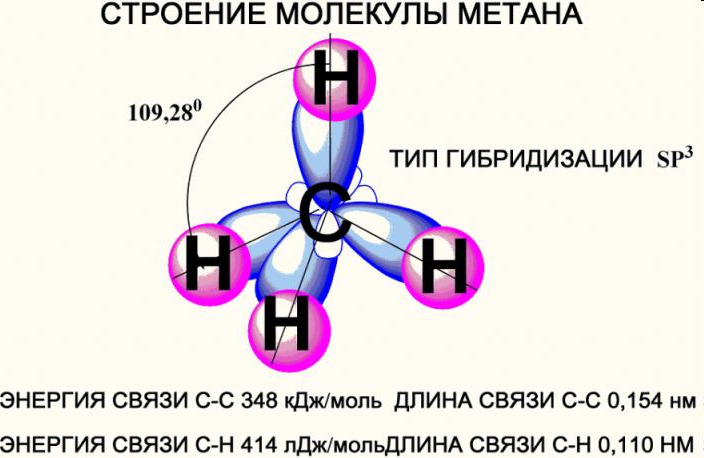
а) электронная и структурная формулы;
б) пространственное строение
Строение молекулы этана С2Н6
Строение молекулы пропана С3Н8 – цепь зигзагообразная
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С 4
4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Сравнительная характеристика гомологов и изомеров

6. Физические свойства
В обычных условиях
С1- С4 – газы
С5- С15 – жидкие
С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
.
ГРУППА 508 БИОЛОГИЯ 3
Тема 3: Углеводы. Липиды.
- Углеводы, или сахариды, — одна из основных групп органических соединений. Они входят в состав клеток всех живых организмов.Основная функция углеводов — энергетическая (при расщеплении и окислении молекул углеводов выделяется энергия, которая обеспечивает жизнедеятельность организма). При избытке углеводов они накапливаются в клетке в качестве запасных веществ (крахмал, гликоген) и при необходимости используются организмом в качестве источника энергии. Углеводы также используются и в качестве строительного материала.Общая формула углеводов:
Cn(H2O)m .Углеводы состоят из углерода, водорода и кислорода. В состав производных углеводов могут входить и другие элементы.
В состав производных углеводов могут входить и другие элементы. Растворимые в воде углеводы. Моносахариды и дисахаридыПример:из моносахаридов наибольшее значение для живых организмов имеют рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза.Глюкоза — основной источник энергии для клеточного дыхания.Фруктоза — составная часть нектара цветов и фруктовых соков.Рибоза и дезоксирибоза — структурные элементы нуклеотидов, являющихся мономерами нуклеиновых кислот (РНК и ДНК).
Растворимые в воде углеводы. Моносахариды и дисахаридыПример:из моносахаридов наибольшее значение для живых организмов имеют рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза.Глюкоза — основной источник энергии для клеточного дыхания.Фруктоза — составная часть нектара цветов и фруктовых соков.Рибоза и дезоксирибоза — структурные элементы нуклеотидов, являющихся мономерами нуклеиновых кислот (РНК и ДНК).
Дисахариды образуются путём соединения двух молекул моносахаридов и по своим свойствам близки к моносахаридам. Например, и те и другие хорошо растворимы в воде и имеют сладкий вкус.Пример:сахароза (тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар) — дисахариды, образовавшиеся в результате слияния двух молекул моносахаридов:сахароза (глюкоза+ фруктоза) — основной продукт фотосинтеза, транспортируемый в растениях.Лактоза (глюкоза+ галактоза) — входит в состав молока млекопитающих.Мальтоза (глюкоза+ глюкоза) — источник энергии в прорастающих семенах.Функции растворимых углеводов: транспортная, защитная, сигнальная, энергетическая.Нерастворимые в воде полисахаридыПолисахариды состоят из большого числа моносахаридов. С увеличением количества мономеров растворимость полисахаридов уменьшается и сладкий вкус исчезает.Пример:полимерные углеводы: крахмал, гликоген, целлюлоза, хитин.Функции полимерных углеводов: структурная, запасающая, энергетическая, защитная.
Крахмал состоит из разветвлённых спирализованных молекул, образующих запасные вещества в тканях растений.Целлюлоза является важным структурным компонентом клеточных стенок грибов и растений.Целлюлоза нерастворима в воде и обладает высокой прочностью.Хитин состоит из аминопроизводных глюкозы, входит в состав клеточных стенок некоторых грибов и формирует наружный скелет членистоногих животных.
Гликоген — резервный углевод животной клетки.В состав соединительных тканей животных входят сложные полисахариды. Они содержатся в межклеточном веществе кожи, в хрящах и сухожилиях. - Липиды — обширная группа жироподобных веществ (сложных эфиров жирных кислот и трёхатомного спирта глицерина), нерастворимых в воде. К липидам относят жиры, воски, фосфолипиды и стероиды (липиды, не содержащие жирных кислот).Липиды состоят из атомов водорода, кислорода и углерода.
 Липиды присутствуют во всех без исключения клетках, но их содержание в разных клетках сильно варьирует (от
Липиды присутствуют во всех без исключения клетках, но их содержание в разных клетках сильно варьирует (от2 –3 до50 –90 %).Липиды могут образовывать сложные соединения с веществами других классов, например с белками (липопротеины) и с углеводами (гликолипиды).Функции липидов:- запасающая — жиры являются основной формой запасания липидов в клетке.
- Энергетическая — половина энергии, потребляемой клетками позвоночных животных в состоянии покоя, образуется в результате окисления жиров (при окислении они дают более чем в два раза больше энергии по сравнению с углеводами).
- Жиры используются и как источник воды (при окислении
1 г жира образуется более1 г воды). - Защитная — подкожный жировой слой защищает организм от механических повреждений.
- Структурная — фосфолипиды входят в состав клеточных мембран.
- Теплоизоляционная — подкожный жир помогает сохранить тепло.
- Электроизоляционная — миелин, выделяемый клетками Шванна (образуют оболочки нервных волокон), изолирует некоторые нейроны, что во много раз ускоряет передачу нервных импульсов.
- Гормональная (регуляторная) — гормон надпочечников (кортизон) и половые гормоны (прогестерон и тестостерон) являются стероидами.
- Смазывающая — воски покрывают кожу, шерсть, перья и предохраняют их от воды. Восковым налётом покрыты листья многих растений, воск используется при строительстве пчелиных сот.
ГРУППА 401 химия 7,8
Тема: 7. Зависимость свойств галогенов от их положения в Периодической системе.
Галогены расположены в 17 группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атомы галогенов имеют 7 электронов, их электронная конфигурация ns2np5. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с металлами и водородом. Атомы галогенов, кроме фтора, могут проявлять положительные степени окисления: +1; +3; +5; +7. Фтор, как самый электроотрицательный элемент, в своих соединениях проявляет степень окисления -1. В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к кислороду. Внутри подгруппы при переходе от фтора к йоду увеличивается радиус атома, уменьшается относительная электроотрицательность, ослабевают неметаллические свойства и окислительная способность.
Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Если для металлов характерны только нулевая степень окисления (в состоянии простого вещества) и положительные степени окисления в соединениях, то неметаллы в своем большинстве проявляют как как нулевые (в простом состоянии), так и положительные и отрицательные степени окисления в соединениях. Только фтор в соединениях всегда проявляет степень окисления -1, и кислород - 2.
Лишь в немногочисленных соединениях со фтором кислород проявляет степень окисления +1
Таким образом, простое вещество фтор в реакция - всегда окислитель, простое вещество кислород в реакциях - почти всегда окислитель. Остальные неметаллы в соединениях могут иметь
как положительные, так и отрицательные степени окисления в соединениях , то есть проявлять как окислительные, так и свойства. восстановительные свойства.
Задание: записать по 3 уравнения реакции характеризующей эти свойства, указать окислители и восстановители.
а) взаимодействие неметаллов с металлами. В этих реакциях металлы всегда восстановители, а неметаллы - всегда окислители.
Чем выше окислительная способность неметалла, тем более глубоким будет окислительное действие на металл. Если металл проявляет переменную степень окисления в соединениях, то более активный неметалл окисляет металл до более высокой степени окисления.
+8
Оs + 4F₂ = OsF₈
2Os + 3Cl₂ = 2OsCl₃
2Os + 2I₂ = 2OsI₂
Малоактивные неметаллы проявляют окислительные свойства только по отношению к активным металлам, например:
2Na⁰ + H₂⁰ = Na⁺H⁻ Ca⁰ + H₂⁰ = Ca⁺²H₂
А вот активный фтор взаимодействует не только с большинством металлов средней активности, но также и со многими металлами, стоящими в ряду напряжений после водорода, например с платиной:
Pt + 2F₂ = PtF4
Как было сказано неметаллы могут вступать в реакцию с другими неметаллами, но при этом надо учитывать, что более активные неметаллы в этих реакциях будут окислителями, а менее активные - восстановителями
Например, в реакции углерода с кислородом
С⁰ + О₂⁰ = С⁺⁴ О₂⁻² углерод - восстановитель, кислород - окислитель.
А в реакции углерода с водородом С + 2Н₂ = С⁻⁴Н₄⁺¹ углерод -окислитель, а водород - восстановитель
Но реакции между неметаллами зависят не только от положения
неметаллов в ряду напряжений, но также от состояния неметаллов и прочности связей между атомами неметаллов в молекуле.
Например, кислород легко реагирует с водородом при поджигании, с фосфором при нагревании, с азотом - при температуре выше 2000⁰ + катализатор, а реакция между хлором и кислородом - практически не осуществима.
В реакции с водой активность неметаллов проявляется по разному.
Сl₂⁰ + H2O + HCl⁻¹ + HCl⁺¹O
По такой же схеме реагирут иод, но реакция протекает очень медленно
Тема 8: Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем энергетическом подуровне, местоположение неметаллов в конце малых и больших периодов, число электронов на внешнем подуровне соответствует номеру группы. В периоде идет возрастание способности присоединять электроны, а в группе это свойство можно наблюдать по мере уменьшения радиуса (в периоде снизу вверх).
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VI и VII групп. Самый сильный окислитель – фтор.
Окислительные свойства неметаллов возрастают в последовательности:
Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду:
Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства:
Сера проявляет как окислительные, так и восстановительные свойства:
S + O2 = SO2 – окислительные свойства серы;
S + H2 = H2S – восстановительные свойства серы.
Примеры окислительно-восстановительных реакций:
· восстановительные свойства – образование оксидов и фторидов неметаллов;
 · окислительные свойства неметаллов – образование галогенидов, сульфидов, карбидов, нитридов, фосфидов.
· окислительные свойства неметаллов – образование галогенидов, сульфидов, карбидов, нитридов, фосфидов.
| К о м а н д а А | К о м а н д а B |
| Na + S = Fe + Cl2 = H2 + N2 = H2 + Cl2 = H2 + О2 = СH4 + O2 = | Mg + F2 = S + O2 = C + O2 = S + F2 = P + Cl2 = H2 + CuO = |
Вопросы для самоконтроля
1. Назовите тип кристаллической решетки, который характерен для металлов. Его особенности.
2. Назовите типы кристаллических решеток, характерные для неметаллов.
|