31.10.22г. ПОНЕДЕЛЬНИК 501,408,406,405
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 501 ХИМИЯ 7,8
ТЕМА7: определение массовой доли химических элементов в сложном веществе.
«Доля» означает часть от целого. Это универсальное математическое понятие. Например, кусок арбуза, изображенный на рисунке, составляет одну четвертую часть от целого арбуза, то есть его доля равна

Рис. 1. Понятие массовой доли
Как определить, какую массовую долю составляет тот или иной химический элемент в составе какого-либо химического соединения? Для этого надо обратиться к формуле этого соединения.
По химической формуле можно рассчитать массовые доли химических элементов в составе химического соединения.
Массовая доля химического элемента показывает, какая часть относительной молекулярной массы соединения приходится на данный химический элемент.
Массовые доли элементов
где
Например, требуется рассчитать массовые доли химических элементов в метане
Найдём относительную молекулярную массу метана:
По формуле рассчитаем массовые доли водорода и кислорода в составе метана:
Аналогично рассчитаем массовые доли химических элементов в азотной кислоте.
Найдём относительную молекулярную массу азотной кислоты
По формуле рассчитаем массовые доли водорода, азота и кислорода в составе азотной кислоты:
 Коротко о главном
Коротко о главном
Зная химическую формулу соединения, можно определить не только его качественный и количественный состав, но и найти массовые доли химических элементов.
Массовая доля химического элемента показывает, какая часть относительной молекулярной массы приходится на данный химический элемент.
 Вопросы для самоконтроля
Вопросы для самоконтроля
- Поясните на конкретных примерах, какую информацию можно извлечь из химической формулы.
- Что показывает массовая доля химического элемента в соединении? Как рассчитать массовую долю химического элемента в соединении?
- Найдите массовые доли химических элементов в следующих соединениях:
; ; ; ;
ГРУППА 408 ХИМИЯ 23,24
Тема 23: Понятие о синтетических моющих средствах. Правила безопасного обращения со средствами бытовой химии. |
ТЕМА24:Глюкоза. Строение молекулы. Изомерия. Физические свойства и нахождение в природе.
В природе наиболее распространены углеводы - моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы). ВИДЕО "УГЛЕВОДЫ"
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных.
Например:
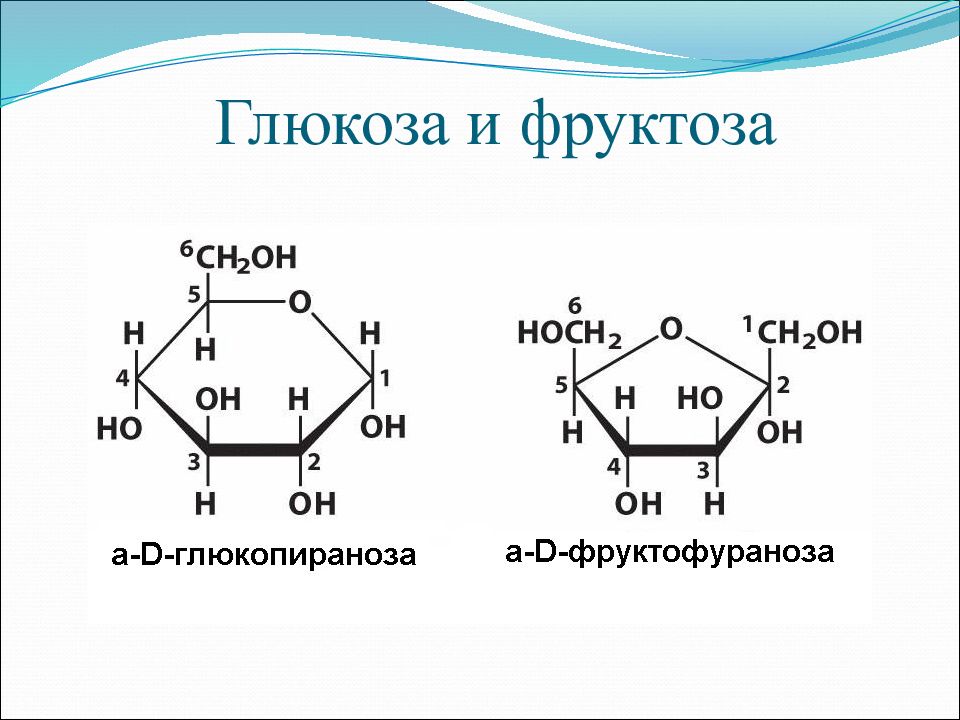
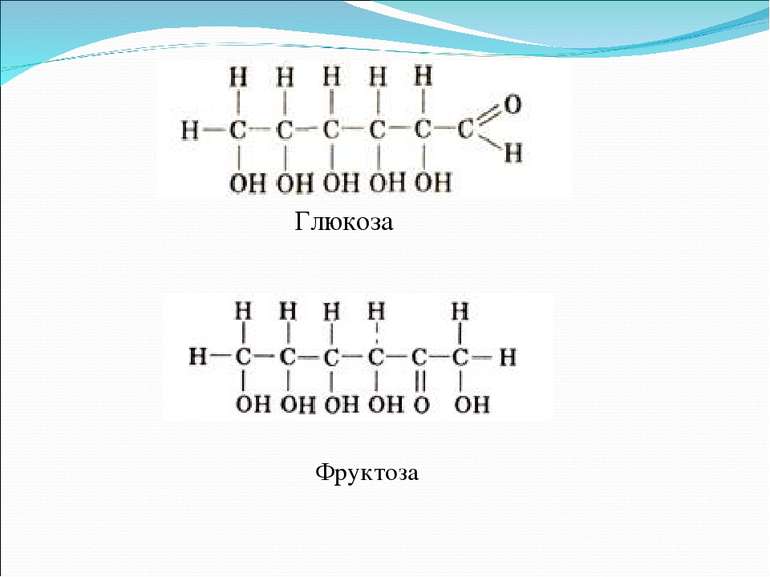
возможно и такое обозначение глюкозы и фруктозы:
Из этих формул следует, что моносахариды – это альдегидоспирты или кетоноспирты.
Строение глюкозы C6H12O6
Экспериментально установлено, что в молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видео. Распознавание глюкозы с помощью качественных реакций
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
В растворе глюкозы эти формы находятся в равновесии друг с другом.
Например, в водном растворе глюкозы существуют следующие структуры:
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении. С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:https://orgchem.ru/vrml/link18.htm
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией (от греческого tauto – «тот же самый» и meros – «часть».
В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
 Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры)
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры)
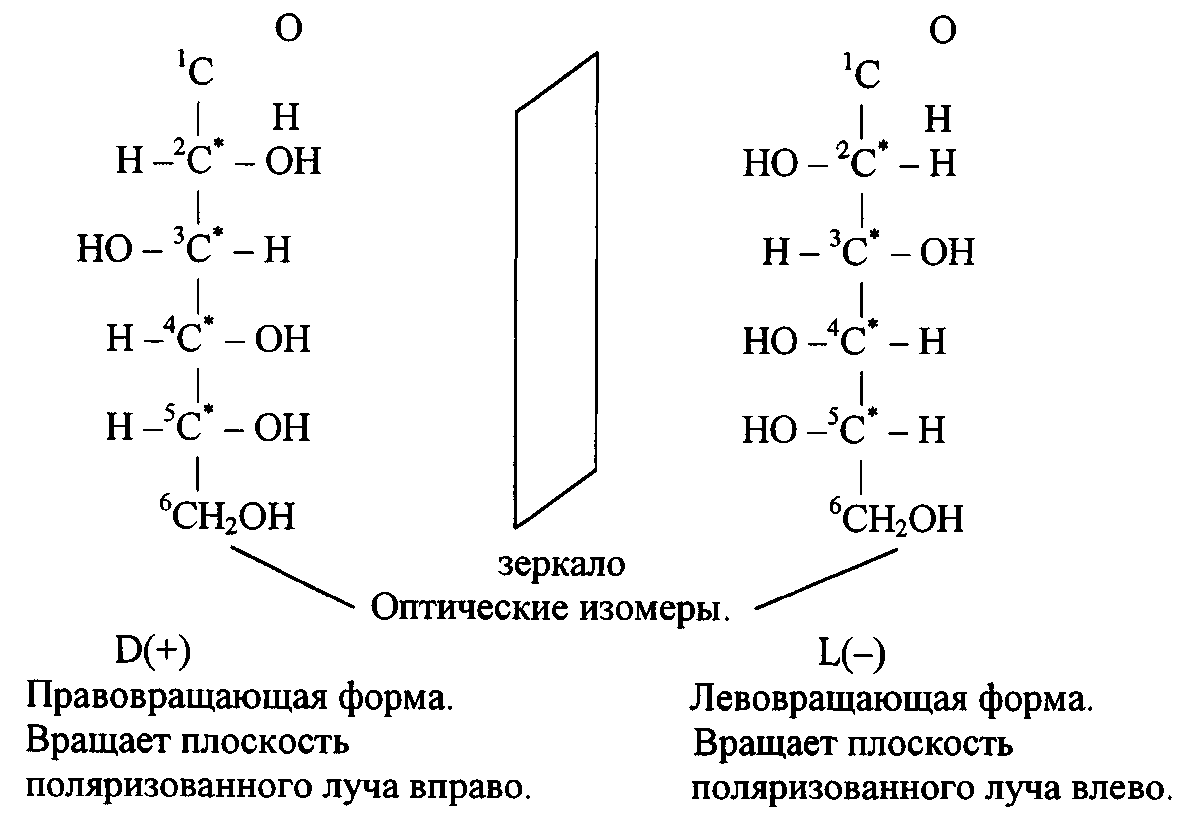
и оптическая изомерия:https://orgchem.ru/vrml/link18.htm
Физические свойства глюкозы:
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий):
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
ГРУППА 406 ХИМИЯ 10
ТЕМА 12:Предмет органической химии. Природные, искусственные и синтетические органические вещества. Сравнение органических веществ с неорганическими. Органические веществаС глубокой древности человек использовал в своих целях вещества живой и неживой природы. Из осколков камней наши предки изготавливали наконечники стрел, из руд выплавляли металлы, глину и известняк использовали для строительства жилищ, из мрамора высекали скульптуры. Вещества природного происхождения служили источником пищи, применялись для изготовления одежды, приготовления лекарств, ядов, красителей. Первые попытки классификации веществ были предприняты ещё в IX—X вв. Арабский алхимик Абу Бакр ар-Рази (865—925) впервые разделил вещества на представителей «минерального, растительного и животного царств». Такое разделение основывалось на том, что «растительные и животные» вещества обладают похожими свойствами: легко разрушаются при нагревании, горят, имеют невысокие температуры кипения и плавления, растворяются в спиртах и маслах. Эта классификация просуществовала почти тысячу лет! В начале XIX в. число веществ, которые были выделены из объектов живой природы, стало стремительно расти. По предложению выдающегося шведского химика Йёнса Якоба Берцелиуса вещества живой природы стали называть органическими в противоположность минеральным, т. е. неорганическим, веществам. Были замечены и другие общие особенности органических соединений. При горении все они в основном образуют углекислый газ, сажу, воду и некоторые другие соединения, а следовательно, обязательно содержат в своём составе углерод.
На ранних этапах развития химии учёные считали, что органические вещества могут образовываться только в живых организмах под действием некой «жизненной силы» (по-латыни vis vitalis). Учение о химическом родстве всех живых организмов получило название витализм. Сторонники витализма полагали, что жизненная сила представляет собой неотъемлемый атрибут живых существ и, следовательно, получить органические вещества вне организма, в пробирке или реакторе, невозможно. Однако ряд открытий, сделанных в середине XIX в., показал, что сторонники витализма глубоко заблуждались. В 1828 г. немецкий химик Фридрих Вёлер впервые получил органическое вещество — мочевину из неорганической соли (цианата аммония). В 1854 г. французский учёный Марселей Бертло синтезировал аналоги природных жиров, затем в 1861 г. русский химик Александр Михайлович Бутлеров — аналог природного сахара. В конечном счёте под давлением экспериментальных фактов витализм потерпел крах. Предмет органической химииПостепенно изучение состава и свойств органических веществ выделилось в самостоятельный раздел химической науки — органическую химию. Было обнаружено, что большое число органических веществ построено из атомов всего двух химических элементов — углерода и водорода. Такие соединения называют углеводородами. Состав углеводородов выражают общей формулой CхHу, где между индексами х и у существует строгое математическое соотношение. Углеводороды занимают особое место в органической химии, поскольку соединения всех остальных классов органических веществ можно рассматривать как их производные. Например, если в молекуле метана СН4 один атом водорода заместить карбоксильной группой —СООН, то получится молекула известной вам уксусной кислоты СН3СООН. Замена одного атома водорода в этане C2H6 на гидроксильную группу – ОН даст в результате молекулу этилового спирта С2Н5ОН. Таким образом, и карбоновые кислоты, и спирты (важнейшие классы органических соединений) можно считать производными углеводородов. Немецкий химик-органик Карл Шорлеммер более ста лет назад сформулировал классическое определение органической химии, не потерявшее своей актуальности до сих пор.
Природные, искусственные и синтетические органические веществаПоняв, как построены органические соединения, учёные научились не только получать их в лаборатории, но и химически модифицировать, т. е. изменять их строение. Мало того, химики смогли синтезировать соединения углерода, никогда не существовавшие в природе. Таким образом, по происхождению органические вещества можно разделить на три группы: природные, искусственные и синтетические. Природные органические вещества — это продукты жизнедеятельности любых живых организмов. Название веществ этой группы говорит о том, что в окружающей среде такие соединения существуют независимо от человека, их можно выделить из природных объектов, будь то полезные ископаемые (нефть, газ, каменный уголь, горючие сланцы), растения или животные. Искусственные органические вещества — это продукты химической модификации природных органических соединений, в результате которой происходит изменение состава и строения исходного вещества с целью придания ему требуемых свойств. Например, в результате химической обработки целлюлозы (основной составной части древесины) получают не существующие в природе волокна (ацетатное, медно-аммиачное, вискозное) и пластмассу (целлулоид). Синтетические органические вещества «рождаются» в пробирках учёных или в реакторах промышленных предприятий и никогда не встречаются в природе. Пожалуй, сегодня это самая многочисленная группа органических веществ, куда входят лекарства, средства бытовой химии, синтетические каучуки, ядохимикаты, пластмассы, красители и др. Многообразие органических веществОрганических веществ гораздо больше, чем неорганических: на сегодняшний день органических веществ насчитывают более 100 млн, а число неорганических не превышает 500 тысяч. Это во многом определяется особенностями строения органических соединений. Одна из причин уникальности углерода как родоначальника органических соединений была выяснена ещё в середине XIX в. Великий русский учёный Дмитрий Иванович Менделеев в учебнике «Основы химии» писал: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах… Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях… Ни в одном из элементов… способности к усложнению не развито в такой степени, как в углероде… Ни одна пара элементов не даёт столь много соединений, как углерод с водородом». Выдающуюся роль в решении вопроса о строении органических соединений сыграл русский химик А. М. Бутлеров. Об этом пойдёт речь в следующем конспекте. Основные выводы по теме конспекта:
|
