Пятница, 30.10.20 г. 206, 308, 106, 201, 108 группы
206 Тема:
Задание: прочитать, кратко -конспект.
Тема урока: Алкены. Этилен и его получение (дегидрирование этана, дегидратация этанола). Химические свойства этилена (горение, качественные реакции), гидратация, полимеризация. Полиэтилен, его свойства, применение.
Алкены - ненасыщенные углеводороды с общей формулой CnH2n, в молекулах которых имеется одна двойная связь С=С.
Особенности строения молекул
В этилене углерод находится в состоянии sp2-гибридизации (в гибридизации участвуют одна s и 2 p-орбитали). У каждого атома углерода в молекуле этилена – 3 гибридные sp2-орбитали и по одной негибридной р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 120°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.
Схема образования σ-связей в молекуле этилена

Две негибридных р-орбитали атомов углерода взаємно перекрываются в плоскости, которая расположена перпендикулярно к плоскости σ-связей, образуя одну π-связь.
Схема образования π-связи в молекуле этилена

Особенности номенклатуры алкенов
Принадлежность углеводорода к классу алкенов отражают суффиксом –ен:
С2Н4 CH2=CH2 этен (этилен)
С3Н6 CH2=CH2-СН3 пропен (пропилен)
С4Н8 CH2=CH2-СН2-СН3 бутен
и т.д.
Чтобы назвать алкен, соединение нумеруют, начиная с того конца, к которому ближе двойная связь.
Положение двойной связи указывают в конце названия номером того атома углерода, от которого она начинается.

Изомерия алкенов
Структурная изомерия.
Изомерия строения углеродной цепи.
Изомерия положения двойной связи.

Пространственная изомерия.
Геометрическая изомерия (цис-/транс-)

Физические свойства
C2H4 – C4H8 – газы, С5Н10 – С17Н34 – жидкости, С18Н36 и выше – твердые вещества.
Получение
В промышленности – из природного газа и при процессах крекинга и пиролиза нефти.
Дегидратация (отщепление воды) спиртов.

Дегидрирование алканов.

Из галогенпроизводных (дегидрогалогенирование)
 :
:
2-бромпропан пропен
Реакции дегидрогалогенирования и дегидратации идут по правилу Зайцева:
Водород отщепляется от соседнего менее гидрированного атома углерода.

И др.
Химические свойства
Реакции присоединения
Взаимодействие с галогенами
Качественная реакция на наличие двойных связей – обесцвечивание бромной воды!

Гидрирование.

kt – Ni, Pt, Pd.
Гидратация (присоединение воды)

Реакции гидратации идут в присутствии серной или ортофосфорной кислот.
1.4 Реакция с галогенводородами (гидрогалогенирование).


Реакции окисления.
Горение.
![]()
Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) – качественная реакция на двойную C=C связь!

Кроме раствора KMnO4, можно использовать другие мягкие оксилители.
Частичное оксиление кислородом воздуха.

Реакции полимеризации.

Катализаторы катионной полимеризации – кислоты, пероксиды, например – H2O2.
Реакция полимеризации – химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы(макромолекулы) полимера.
Полимер – высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
Применение этилена – сырье для производства горючего, пластмасс, взрывчатых веществ, антифризов, растворителей, ацетальдегида, этилового спирта, синтетического каучука, уксусной кислоты и др.
Применение полиэтилена – материал для изготовления медицинского оборудования, предметов домашнего обихода, тары, пленок, клейкой ленты, деталей и др.
САМОПРОВЕРКА.
Как получают этилен: а) в промышленности, б) в лаборатории.
По аналогии с этиленом напишите уравнения реакций получения пропена: а) из пропана, б) из пропанола-1.
С помощью каких реакций можно отличить этилен от этана?
Группа 308 Тема:.Циклоалканы: строение, свойства, получение и применение.
иклоалканы – предельные циклические углеводороды. Простейшие представители:
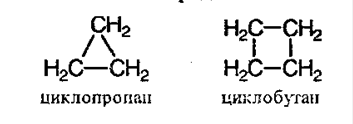
Общая формула – СnH2n.
Строение циклоалканов.
Атомы углерода находятся в sp3 – гибридизации. Угол зависит от размера цикла.
Изомерия циклоалканов.
Для циклоалканов характерна изомерия углеродного скелета и пространственная изомерия:

Все соединения делят на малые (С3, С4) циклы и на обычные (C5 – С7) циклы.
Физические свойства циклоалканов.
При обычных условиях:
С3, С4 – газы;
С5-С16 – жидкости;
С17 и выше – твердые вещества.
Температуры плавления и кипения выше, чем у алканов.
Получение циклоалканов.
1. Отщепление 2х атомов галогена от дигалогенов:

2. Гидрирование ароматических углеводородов:

Химические свойства циклоалканов.
Малые и обычные циклы имеют различные свойства. Например, для циклобутана и циклопропана свойственна реакция присоединения:
А) брома:

Б) водорода (в присутствие никелевого катализатора):

В) галогенводорода (по правилу Марковникова):

Реакция замещения свойственна для обычных циклов, т.к. они более устойчивы:

Дегидрирование:

Под воздействием окислителей образуется кислота:

Применение циклоалканов.
Циклоалканы используют для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан выступает в качестве ингаляционного средства.
При прямом развитии на свет появляется особь, похожая на взрослую, но значительно меньших размеров. Её дальнейшее развитие сводится главным образом к росту и половому созреванию.




- развитие организма во взрослую особь (ювенильный период) обычно проходит за более короткий промежуток времени;
- не происходит существенной перестройки организма, и поэтому требуется меньше энергии и питательных веществ.
- для осуществления эмбрионального развития требуется большое количество питательных веществ в яйцеклетках или внутриутробное развитие потомства;
- при перенаселении обостряется внутривидовая конкуренция между молодыми и зрелыми особями, так как им необходимы одинаковые жизненные ресурсы.
- у многих видов животных личинки и взрослые особи занимают разные экологические ниши — это снижает внутривидовую конкуренцию;
- у малоподвижных или прикреплённых животных личинки способствуют расселению вида, расширению его ареала.
- развитие во взрослую особь обычно занимает длительный промежуток времени;
- для метаморфоза требуется много пищи и энергии.
|
Предмет
органической химии. Природные,
искусственные и синтетические органические вещества. Сравнение органических
веществ с неорганическими. План
Проблемный вопрос. В настоящее время известно более 27 млн. органических соединений, причем ежегодно эта цифра значительно увеличивается. В то же время неорганических веществ известно порядка нескольких сотен тысяч. Что же объединяет все органические вещества? Почему они столь многочисленны? Проблемный вопрос. Почему именно углерод – центральный элемент органической химии? Почему ни один другой элемент в природе не может дать такого огромного количества соединений. Выскажите своё предположение.
Исключения: CO, CO2, H2CO3, MCO3, MHCO3, MC, CS2 Закрепление. Составление таблицы.
ГРУППА 108. Тема:Электролитическая диссоциация. Сильные и слабые
электролиты. Среда водных растворов. Водородный показатель (рН) раствора. Электролитами называют вещества, которые в расплавленном или растворенном состоянии проводят электрический ток. К электролитам относят большинство неорганических и органических кислот, оснований и солей. К неэлектролитам относят вещества, растворы или расплавы которых не обладают электропроводностью. Это, например, N2, O2, CO, многие органические вещества (углеводороды, спирты, эфиры, сахара и др.). В 1887 году шведский ученый Сванте Аррениус после тщательного экспериментального изучения электропроводности растворов различных веществ предложил теорию электролитической диссоциации. Электролитическая диссоциация – это полный или частичный распад молекул или ионных кристаллов растворенного вещества на катионы и анионы при растворении в воде. Таким образом, в растворах электролитов в заметной концентрации присутствуют ионы, обусловливающие электропроводность. Кроме того, электролитическая диссоциация приводит к увеличению общего числа частиц в растворе, что и является причиной существенных различий между свойствами растворов электролитов и неэлектролитов, в частности, увеличения ΔТкип и ΔТкр растворов электролитов по сравнению с соответствующими значениями для растворов неэлектролитов. Причины электролитической диссоциации Молекула воды полярна: вследствие смещения электронной плотности атомы водорода приобретают частичный положительный заряд, а более электроотрицательный атом кислорода – частичный отрицательный заряд. Таким образом, молекулу воды можно представить как диполь: Диэлектрическая проницаемость воды при 25 оС равна 79. Одной из причин электролитической диссоциации является взаимодействие растворенного вещества с полярными молекулами воды, приводящее к образованию в растворе гидратированных ионов: Кроме того, электростатическое взаимодействие между образовавшимися в растворе катионами и анионами ослабляется почти в 80 раз за счет высокой диэлектрической проницаемости воды. Наконец, именно при гидратации ионов выделяется энергия, необходимая для распада молекул или кристаллических решеток веществ на ионы. Отметим, что электролитическая диссоциация происходит не только в воде, но и в других полярных растворителях: в жидком аммиаке, безводной уксусной кислоте и др. Степень электролитической диссоциации
Степень электролитической диссоциации α равна отношению числа молекул, распавшихся на ионы, к общему числу молекул электролита, введенных в раствор.
Иными словами, α – это доля молекул электролита, распавшихся на ионы. Степень диссоциации выражается в долях единицы или в процентах и изменяется от 0 (диссоциации нет) до 1 или 100% (полная диссоциация): 0 ≤ α ≤ 1 или 0 ≤ α ≤ 100%. Сильные и слабые электролиты
По степени диссоциации электролиты подразделяют на сильные и слабые. Принято считать сильными те электролиты, для которых
Ступенчатая диссоциация Многоосновные кислоты и многокислотные основания диссоциируют ступенчато: вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. Так, диссоциацию ортофосфорной кислоты можно представить уравнениями: первая ступень H3PO4 вторая ступень H2PO4- третья ступень HPO42- Водородный показатель
В чистой воде [H+] = [OH-], так как при диссоциации воды образуется равное количество ионов H+ и OH-. При 22 оС [H+] = [OH-] = 10-7 моль/л. В растворе кислоты [H+] > 10-7, а [OH-] < 10-7 моль/л. Наоборот, в щелочном растворе [OH-] > 10-7, а [H+] < 10-7 моль/л. Концентрации ионов Н+ и ОН- взаимосвязаны: как бы ни менялись значения [H+] и [OH-], их произведение всегда останется равным 10-14 (при 220С). Отсюда следует, что и кислотный, и щелочной раствор можно охарактеризовать через концентрацию ионов H+: [H+] = 10-7 моль/л – раствор нейтральный; [H+] > 10-7 моль/л – раствор кислотный; [H+] < 10-7 моль/л – раствор щелочной.
На практике используют водородный показатель, или рН. pН = − lg [H+]. В нейтральной среде pH = 7; в кислотных растворах pH < 7; в щелочных растворах pH > 7. Шкала рН Наглядно шкалу рН можно выразить схемой Многие химические реакции протекают при строго определенных значениях рН среды. Изменение рН может повлиять не только на скорость реакции, но и привести к образованию совершенно других продуктов. Большое значение имеет рН и в биологических процессах. Так, плазма крови здорового человека имеет слабощелочную среду (рН 7,36), причем понижение ее рН даже до 7,1 может привести к необратимым нарушениям жизнедеятельности организма. В то же время рН желудочного сока колеблется в пределах 0,9-1,6, кишечного сока – 6,0-7,6. В норме слюна имеет слабощелочную реакцию (рН 7,0-8,0), а слезная жидкость – нейтральную (рН около 7). |
|||||||||||||||||||||||||||