Понедельник 26.10.20г. группы 206, 303, 308, 301, 108
Гр.206 тема:
Химические свойства алканов, и их применение.
Химические свойства алканов
Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH2-) и метильные (-CH3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, цик
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
|
Типы химических реакций |
Описание |
Уравнение |
|
Галогенирование |
Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы |
CH4 + Cl2 → CH3Cl + HCl |
|
Нитрование (реакция Коновалова) |
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы |
CH3-CH3 +HNO3 → CH3-CH2-NO2 + H2O |
|
Сульфохлорирование |
Сопровождается окислением с образованием алкансульфонилхлоридов |
R-H + SO2 + Cl2 → R-SO3Cl + HCl |
|
Сульфоокисление |
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H |
C5H10 + HOSO3H → C5H11SO3H + H2O |
|
Крекинг |
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены |
C4H10 → C2H6 + C2H4 |
|
Горение |
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи |
– CH4 + 2O2 → CO2 + 2H2O; – 2CH4 + 3O2 → 2CO + 4H2O |
|
Каталитическое окисление |
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты |
C4H10 → 2CH3COOH + H2O |
|
Дегидрирование |
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены |
C2H6 → C2H4 + H2 |
|
Ароматизация |
Реакция дегидрирования с образованием циклоалканов |
C6H14 → C6H6 + 4H2 |
|
Изомеризация |
Образование изомеров под действием температуры и катализаторов |
C5H12 → CH3-CH(CH3)-CH2-CH3 |
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.
Подробнее: https://obrazovaka.ru/himiya/himicheskie-svoystva-alkanov-primenenie.html
Гр. 303
Тема: Ионная связь.
Ионная связь
Это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион).
Запомни! Как правило, ионная связь образуется между атомами металлов и атомами неметаллов.

Например, на рисунке сверху изображены атомы натрия и фтора. Натрий - щелочной металл, представитель IA группы, имеет всего 1 валентный электрон и проявляет восстановительные свойства (электроотрицательность по шкале Полинга =0,98). Фтор - представитель галогенов (VIIA группа), имеет 7 валентных электронов, является сильным окислителем (=4,0). Фтор, будучи более электроотрицательным, "забирает" у атома натрия валентный электрон и превращается в анион, а атом натрия - в катион.
Ионная связь образуется за счет сил электростатического притяжения между разноименно заряженными частицами: катионами и анионами.
Характеристики ионной связи
В отличие от ковалентной связи, ионная связь является ненасыщенной и ненаправленной. Это легко себе представить: ведь взаимодействие ионов в пространстве не зависит от направления, а каждый анион может притягивать к себе несколько катионов.
Следует подчеркнуть, что полностью ионной связи не существует. Корректнее говорить об "ионности", или ионном характере связи. В случае, если разница ЭО составляет более 2 (например, между щелочными металлами и галогенами), происходит почти полная "передача" электрона к более электроотрицательному элементу с образованием соответствующих ионов.
Гр. 308 Тема: Решение задач на нахождение молекулярной формулы газообразного углеводорода.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
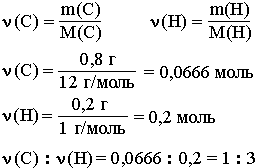
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача . При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
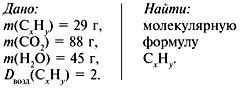
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
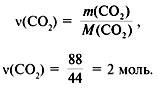
4. Найти количество вещества углерода в сожженном веществе:
![]() (C) =
(C) = ![]() (CO2) = 2 моль.
(CO2) = 2 моль.
5. Найти количество вещества воды:
![]() (H2O) = 45/18 = 2,5 моль.
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
![]() (H) = 2
(H) = 2![]() (H2O),
(H2O),
![]() (H) = 2,5•2 = 5 моль.
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
![]() (C) :
(C) : ![]() (Н) = 2 : 5,
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача . При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.

2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
![]() (CO2) = 16,8/22,4 = 0,75 моль,
(CO2) = 16,8/22,4 = 0,75 моль,
![]() (C) = 0,75 моль.
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
![]() (H2O) = 13,5/18 = 0,75 моль,
(H2O) = 13,5/18 = 0,75 моль,
![]() (H) = 0,75•2 = 1,5 моль.
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
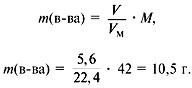
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
![]() (C) :
(C) : ![]() (H) = 0,75 : 1,5 = 1 : 2,
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Группа 301. Тема. Чистые вещества и смеси.
Посмотрите видео и составьте план-конспект
Группа 108
Тема:Химическое равновесие.
Химическое равновесие
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB « pC + dD константа равновесия равна
K = K1 / K2 = ([C]p
- [D]d) / ([A]m [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
| V1 | ||
| A + Б | « | В |
| V2 |
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
| V1 | |||
| A + Б | « | В | ; увеличение P приводит к V1> V2 |
| V2 | |||
| 2 | 1 |
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
| V1 | ||
| A + Б | « | В + Q, то увеличение t°C приводит к V2> V1 |
| V2 |
| V1 | ||
| A + Б | « | В - Q, то увеличение t°C приводит к V1> V2 |
| V2 |
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.


Комментариев нет:
Отправить комментарий