ВТОРНИК, 10.11.20 г. 301, 106 группы
ГРУППА 301, ХИМИЯ.
Тема: Вода. Растворы. Растворение. Вода как растворитель.
Сегодня мы поговорим о веществе – воде!
А видел ли кто-нибудь из вас воду?
Вопрос показался вам нелепым? Но он относится к совершенно чистой воде, в которой нет никаких примесей. Если быть честным и точным в ответе, то придется сознаться, что такую воду ни я, ни вы пока не видели. Именно поэтому на стакане с водой после надписи «Н2О» стоит знак вопроса. Значит, в стакане не чистая вода, а что тогда?
В этой воде растворены газы: N2, O2, CO2, Ar, соли из почвы, катионы железа из водопроводных труб. Кроме того, в ней взвешены мельчайшие частицы пыли. Вот что мы называем ч и с т о й в о д о й! Много ученых работает над решением трудной проблемы – получить абсолютно чистую воду. Но пока получить такую ультрачистую воду не удалось. Однако вы можете возразить, что есть дистиллированная вода. Кстати, что она собой представляет?
На самом деле мы получаем такую воду, когда стерилизуем банки перед консервированием. Переворачиваем банку вверх дном, помещаем ее над кипящей водой. На донышке банки появляются капельки, это и есть дистиллированная вода. Но как только мы перевернем банку, в нее заходят газы из воздуха, и снова в банке – раствор. Поэтому грамотные хозяйки стараются сразу после стерилизации заполнить банки нужным содержимым. Говорят, что продукты в этом случае будут храниться дольше. Возможно, они правы. Можете поэкспериментировать! Именно потому, что вода способна растворять в себе различные вещества, ученые не могут до сих пор получить идеально чистую воду в больших объемах. А она бы так пригодилась, например, в медицине для приготовления лекарств.
Кстати, находясь в стакане, вода «растворяет» стекло. Поэтому чем толще стекло, тем дольше прослужат стаканы. А что такое морская вода?
Это раствор, в котором содержится много веществ. Например, поваренная соль. А как можно выделить поваренную соль из морской воды?
Выпариванием. Кстати, именно так поступали наши предки. В Онеге были солеварни, где из морской воды выпаривали соль. Соль продавали новгородским купцам, покупали своим невестам и женам дорогие украшения, шикарные ткани. Таких нарядов, как у поморок, не было даже у московских модниц. А все лишь благодаря знаниям свойств растворов! Итак, сегодня мы с вами говорим о растворах и растворимости. Запишем в тетради определение раствора.
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Раccмотрим схемы 1–2 и разберем, какие бывают растворы.
Какой из растворов вы предпочтете, готовя суп? Почему?
Определите, где разбавленный раствор, где концентрированный раствор медного купороса?
Если в определённом объёме раствора содержится мало растворённого вещества, то такой раствор называют разбавленным, если много – концентрированным.
Определите, где какой раствор?
Не следует смешивать понятия «насыщенный» и «концентрированный» раствор, «ненасыщенный» и «разбавленный» раствор.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем. Посмотрите видео "РАСТВОРИМОСТЬ ТВЁРДЫХ ВЕЩЕСТВ В ВОДЕ"
Выполните задание в тетради: Распределите предложенные вещества - СO2 , H2, O2 , H2SO4, Уксус, NaCl, Мел, Ржавчина, Растительное масло, Спирт в пустые столбики таблицы 1, используя свой жизненный опыт.
Таблица 1
Растворенное | Примеры веществ | |
Растворимые | Малорастворимые | |
Газ | ||
Жидкость | ||
Твердое вещество | ||
А можете ли вы сказать о растворимости FeSO4?
Как же быть?
Для того чтобы определить растворимость веществ в воде, мы будем пользоваться таблицей растворимости солей, кислот и оснований в воде. Она находится в приложениях к уроку.
В верхней строке таблицы – катионы, в левом столбце – анионы; ищем точку пересечения, смотрим букву – это и есть растворимость.
Н – нерастворимые вещества (меньше 0,01 г в 100 г воды), М – малорастворимые (0,01–10 г в 100 г воды), Р – растворимые (более 10 г в 100 г воды). |
Определим растворимость солей: AgNO3, AgCl, CaSO4.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде. Посмотрите "Тепловые явления при растворении"
Попробуйте сами, пользуясь таблицей, определить растворимость веществ.
Задание. Определить растворимость следующих веществ: AgNO3, Fe(OH)2, Ag2SO3, Ca(OH)2, CaCO3, MgCO3, KOH.
ОПРЕДЕЛЕНИЯ по теме «Растворы»
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Ненасыщенный раствор - это раствор, в котором при данной температуре вещество ещё может растворяться.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества.
Концентрированные растворы - растворы с большим содержанием растворенного вещества.
ДОПОЛНИТЕЛЬНО:
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) - величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы - растворы с небольшим содержанием растворенного вещества; концентрированные растворы - растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Растворимость веществ
По растворимости в воде все вещества делятся на три группы:
1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые.
Последние называют также нерастворимыми веществами. Однако следует отметить, что
абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек
золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как
известно, растворы серебра или золота в воде убивают микробов. Стекло, серебро, золото - это
примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также
отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные
вещества).
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые
вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные
вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить
сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества),
хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ.
Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен
взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора,
различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по
относительным количествам растворенного вещества и растворителя растворы подразделяют на
разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не
растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом,
называют насыщенным, а раствор, в котором еще можно растворить добавочное
количество данного вещества, — ненасыщенным.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к
массе растворителя называют растворимостью этого вещества, или коэффициентом
растворимости:
,
Зависимость растворимости веществ от температуры и природы растворителя.
Растворимость веществ существенно зависит от природы растворяемого вещества и
растворителя, температуры и давления. Причины различной растворимости веществ до конца не
выяснены, хотя их связывают с характером взаимодействия молекул растворителя и
растворенного вещества. Например, известно, что молекулярные кристаллы, структурными
единицами которых являются молекулы с ковалентным неполярным типом связи (сера и др.),
практически нерастворимы в воде, так как энергия разрушения кристаллической решетки
настолько велика, что не может быть компенсирована теплотой сольватации, которая очень мала.
Еще до обоснования теории растворов опытным путем было установлено правило, согласно
которому подобное растворяется в подобном. Так, вещества с ионным (соли, щелочи) или
полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, в
первую очередь в воде. И наоборот, растворимость кислорода в бензоле, например, на порядок
выше, чем в воде, так как молекулы О 2 и С 6 Н 6 неполярны.
Для подавляющего большинства твердых тел растворимость увеличивается с
повышением температуры.
Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись
кристаллы соли, то образуется пересыщенный раствор. Пересыщенным называют раствор, в
котором при данной температуре содержится большее количество растворенного вещества, чем в
насыщенном растворе. Пересыщенный раствор неустойчив, и при изменении условий (при
встряхивании или внесении в раствор затравки для кристаллизации) выпадает осадок, над
которым остается насыщенный раствор.
В отличие от твердых тел растворимость газов в воде с повышением температуры
уменьшается, что обусловлено непрочностью связи между молекулами растворенного вещества
и растворителя. Другой важной закономерностью, описывающей растворимость газов в жидкостях,
является закон Генри: Растворимость газа прямо пропорциональна его давлению над
жидкостью.
Прочитайте о растворимости различных вещест (см. приложения) и выполните задания тренажёра
Законы Менделя кратко и понятно
 В 19 веке австрийский ботаник и биолог Грегор Иоганн Мендель проводил исследования посевного гороха. Он смог установить, как передаются признаки по наследству. Это исследование выявило три закономерности, которые получили название «Законы Менделя».
В 19 веке австрийский ботаник и биолог Грегор Иоганн Мендель проводил исследования посевного гороха. Он смог установить, как передаются признаки по наследству. Это исследование выявило три закономерности, которые получили название «Законы Менделя».
Открытие Менделя заложило основу генетики, науки изучающей вопросы наследования и изменения особенностей организмов. Она сгорала большую роль в развитии различных сфер человеческой деятельности.
Содержание:
Закон единообразия
Закон расщепления
Закон независимого наследования признаков
Заключение
Закон единообразия
Порядок проведения эксперимента
Этот закон был установлен в ходе первого этапа эксперимента. Были взяты два гороха с разными особенностями – разным цветом семян. Они были обозначены как родительские растения или «РР». Одни были желтые, другие зеленые. Для чистоты эксперимента проводилось искусственное опыление.
Результат
Результатом стало появление гороха первого поколения «F1». У таких растений семена всегда были желтыми. Это значит, что второе поколение представляло собой один определенный тип и имело признаки только одного из растений первого поколения (желтый цвет в данном случае). Такие признаки называются доминантными.
Таким образом у всего второго поколения проявилось единообразие, что и дало название закону.
Закон расщепления
Порядок проведения эксперимента
Для следующего этапа исследования использовался только горох первого поколения. Мендель высадил его и оставил без вмешательства, чтобы горох мог самостоятельно опылиться. Это позволило появиться растениям второго поколения «F2».
Результат
Из-за самостоятельного опыления появились семена желтого и зелёного цвета. А поскольку жёлтый цвет является доминантным признаком, то соотношение семян желтого цвета к зеленому составило 3 к 1.
Разделение, а точнее расщепление родительского типа на два различных, дало название второму закону.
Данный опыт помог установить, что признак одного из родителей (зеленый цвет) не исчез полностью, а просто неактивен или подавлен. За него отвечал тот же ген, что и за желтый цвет, за который отвечала часть гена – доминантный аллель. Желтый цвет в себе содержала рецессивная аллель – «а», подавляемая доминантной «А».
Поэтому строение растений:
зеленый горох-родитель – две рецессивных аллели «аа»;
желтый горох-родитель – две доминантных аллели «АА»;
желтый горох первого поколения – одна доминантная и одна рецессивная аллели «Аа»;
желтый горох второго поколения – он может содержать следующие аллели: «АА», «Аа», «аА». В них цвет обуславливается наличием доминанта;
зеленый горох второго поколения – две рецессивных аллели «аа».
Третий закон независимого наследования признаков
Порядок проведения эксперимента
Для третьего опыта Мендель использовал растения гороха с несколькими различающимися признаками: цвет семян и их гладкость. Один вид имел семена гладкие желтые, а второй – зеленые и ребристые.
В первом поколении растение приобрело следующие признаки: желтый цвет и гладкость семян.
Во втором поколении уже наблюдалось расщепление:
желтый цвет и гладкие семена;
желтый цвет и ребристые семена;
зеленый цвет и гладкие семена;
зеленый цвет и ребристые семена.
Получившийся результат говорит о том, что передача и наследование двух разных признаков не зависит друг от друга. А соответственно за гладкость отвечает другой ген, у которого своей набор аллелей. Гладкие семена обуславливаются сочетанием аллелей «BB», «Bb», «bB».
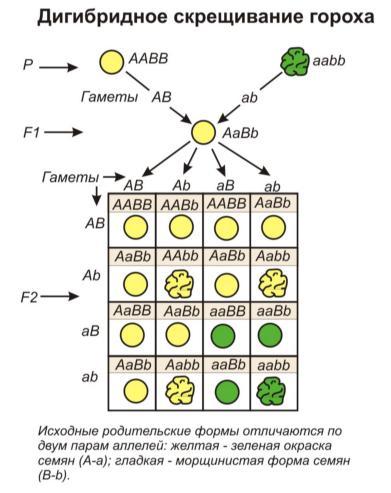
Таким образом строение растений:
зеленый горох-родитель с ребристыми семенами – «аа» и «bb»;
желтый горох-родитель с гладкими семенами – «АА» и «BB»;
желтый горох первого поколения с гладкими семенами – «Аа» и «Bb»;
желтый горох второго поколения с гладкими семенами – «АА», «Аа», «аА» в сочетании с «BB», «Bb», «bB».
желтый горох второго поколения с ребристыми семенами – «АА», «Аа», «аА» и «bb»
зеленый горох второго поколения с гладкими семенами – «аа» в сочетании с «BB», «Bb», «bB»;
зеленый горох второго поколения с ребристыми семенами «аа» и «bb».
Таким образом соотношение цветов и гладкости: 9-3-3-1.
Заключение
В ходе экспериментов Мендель смог установить, что любой ген может содержать рецессивную и(или) доминантную части. Она подавляет рецессивную. Обе эти части впоследствии были названы аллелями. При соединении растений с разными генами, их аллели будут передаваться независимо друг от друга, что начнет проявляться во втором поколении. Если в первом поколении растение приобретает только доминантные признаки, то во втором начнут проявляться и рецессивные. На этом и основываются три закона Менделя и это позволяет ученым-генетикам предугадывать поведение организма при размножении.
Материал взят с сайта https://nauka.club
Второй закон Менделя (закон расщепления): При скрещивание гетерозиготных гибридов первого поколения происходит расщепление признаков в соотношении 3:1.
Третий закон Менделя (закон независимого наследования признаков): При дигибридном скрещивании расщепление по каждой паре признаков идет независимо от других признаков.








Комментариев нет:
Отправить комментарий