12.03.21 г. 303, 201
ГРУППА 303
ТЕМА: Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
1) Для неметаллов характерны реакции с металлами, при это они проявляют окислительные свойства и в образующихся бинарных соединениях проявляют отрицательную степень окисления.
2) Взаимодействие с другими неметаллами:
- взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
Следует помнить, что такие неметаллы как кремний, фосфор, бор с водородом непосредственно не реагируют.
- взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O
C + O
Наиболее типичные неметаллы – галогены – с кислородом не реагируют. Это неудивительно, ведь кислород, как и галогены – сам является сильным окислителем. При взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
- неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя, менее электроотрицательный – роль восстановителя:
Практическая
работа №2
|
Задачи
1
Условие:
Получение, собирание и распознавание водорода.
Решение:
При добавлении к цинку соляной кислоты наблюдается выделение бесцветного газа — водорода.
При поднесении к спиртовке слышен свистящий звук. Следовательно, водород не чистый, а смешан с воздухом.
Водород собирают в перевернутую пробирку, т. к. он легче воздуха.
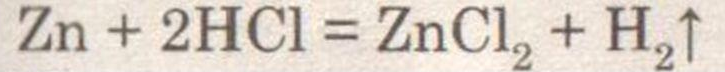
2
Условие:
Получение, собирание и распознавание кислорода.
Решение:
При добавлении оксида марганца (IV) пероксид водорода бурно разлагается.
При внесении в пробирку тлеющей лучинки, она разгорается, что свидетельствует о наличии кислорода.
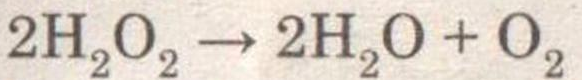
3
Условие:
Получение, собирание и распознавание углекислого газа.
Решение:
При добавлении раствора уксусной кислоты к мрамору (мелу) наблюдается бурное выделение углекислого газа.
При внесении в пробирку горящей лучины, она гаснет.
При пропускании углекислого газа через раствор известковой воды она мутнеет, а потом вновь становится прозрачной.
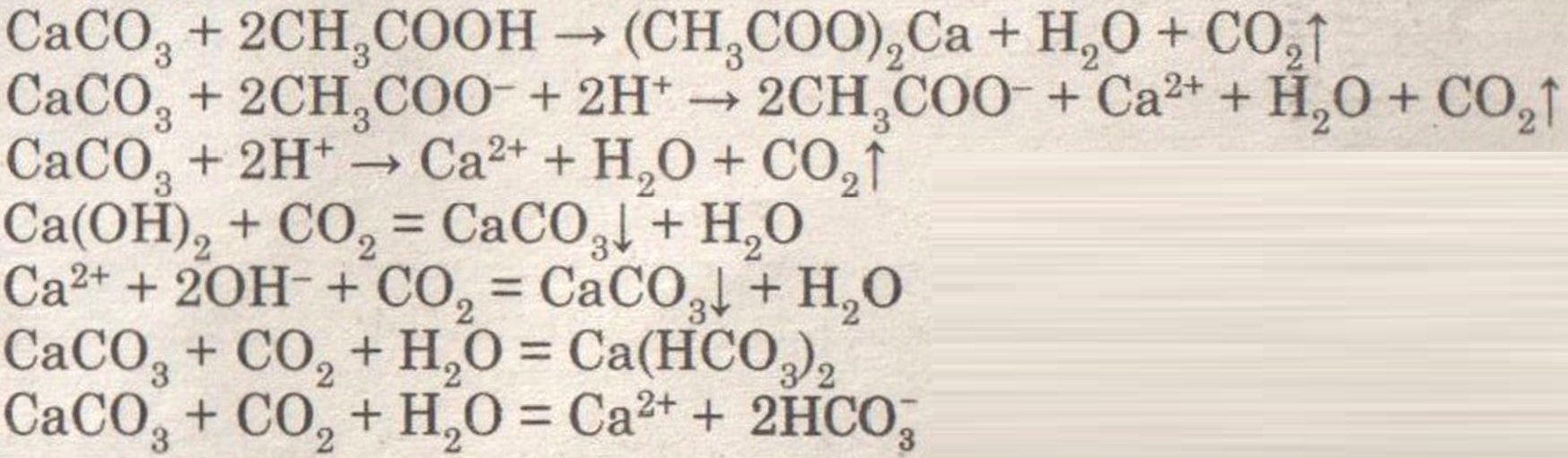
4
Условие:
Получение, собирание и распознавание аммиака.
Решение:
Ощущается запах аммиака.
Влажная лакмусовая бумажка синеет.
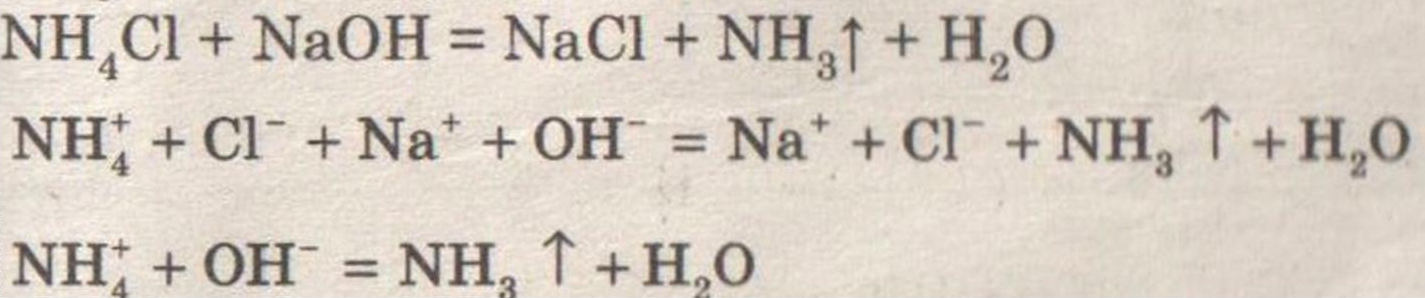
Аммиак имеет резкий запах!
ТЕМА:Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Применение уксусной кислоты на основе свойств.
Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.

Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
|
Взаимодействие |
Что образуется |
Пример |
|
С металлами |
Соль, водород |
Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
|
С оксидами |
Соль, вода |
CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
|
С основаниями |
Соль, вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С солью |
Соль, углекислый газ, вода |
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
|
С неметаллами (реакция замещения) |
Органическая и неорганическая кислоты |
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl; – CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF; – CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI |
|
С кислородом (реакция окисления) |
Углекислый газ и вода |
CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Рис. 3. Использование уксусной кислоты.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
- Вопрос 1 из 5Как выглядит формула уксусной кислоты?
Подробнее: https://obrazovaka.ru/himiya/himicheskie-svoystva-uksusnoy-kisloty-poluchenie.html


Комментариев нет:
Отправить комментарий