12.04.21г. 303,305,306
ГРУППА 303
ТЕМА 1: АЛКАНЫ. СТРОЕНИЕ.
1. Алканы – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
2. Общая формула алканов – СnH2n+2
В таблице представлены некоторые представители ряда алканов и их радикалы.
Формула | Название | Название радикала |
CH4 | метан | - CH3 метил |
C2H6 | этан | - C2H5 этил |
C3H8 | пропан | - C3H7 пропил |
C4H10 | бутан | - C4H9 бутил |
C4H10 | изобутан | изобутил |
C5H12 | пентан | пентил |
C5H12 | изопентан | изопентил |
C5H12 | неопентан | неопентил |
C6H14 | гексан | гексил |
C7H16 | гептан | гептил |
C10H22 | декан | децил |
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)
3. Строение:
Основные характеристики:
пространственное строение – тетраэдрическое
sp3 – гибридизация,
‹ HCH = 109 ° 28
Углеродная цепь - зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана
а) электронная и структурная формулы;
б) пространственное строение
Строение молекулы этана С2Н6
Строение молекулы пропана С3Н8 – цепь зигзагообразная
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Сравнительная характеристика гомологов и изомеров

6. Физические свойства
В обычных условиях
С1- С4 – газы
С5- С15 – жидкие
С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
ГРУППА 303
ТЕМА 2 : ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ.
1. Реакции замещения. а) Галогенирование при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов ) В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г (Г - это галогены F, Cl, Br, I) CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) ; метан хлорметан CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия); дихлорметан СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия); трихлорметан CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия). тетрахлорметан Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле: Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.На атом углерода в метильной группе ( - СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю: CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl хлорэтан 1,1 -дихлорэтан Со фтором реакция идёт со взрывом. С хлором и бромом требуется инициатор. Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции. Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C. б) Нитрование (реакция М.И. Коновалова, он провёл её впервые в 1888 г) CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O нитрометан RNO2 или Сn H2n+1 NO2 (нитроалкан) 2. Реакции отщепления (дегидрирование) а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2 б) При нагревании до 1500 С происходит образование ацетилена и водорода: 2CH4 1500°С → C2H2 + 3H2 3. Реакции перегруппировки (изомеризация) н-алкан AlCl3, t°С → изоалкан 4. Реакции горения (горят светлым не коптящим пламенем) CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O Помните! Смесь метана с воздухом и кислородом взрывоопасна V(CH4) : V(O2) = 1: 2 V(CH4) : V(воздуха) = 1 : 10 5. Реакции разложения а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи: C10H22 t°С → C5H12 + C5H10 алкан алкен б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С и Н2: СH4 1000°С → C + 2H2 в) Конверсия метана с образованием синтез – газа (СО + Н2) CH4 + H2O 800˚C, Ni → СО + 3Н2 Видео: Горениепарафина в условиях избытка и недостатка кислорода Горение метана и изучение его физических свойств Горение твердых углеводородов (напримере парафина) Установление качественного составапредельных углеводородов Определение содержания хлора ворганических соединениях Отношение метана к растворуперманганата калия и бромной воде |
ГРУППА 306
ТЕМА 1:Контрольная работа
При выполнении заданий выберите только один из четырёх предложенных вариантов ответа.
А 1. Укажите номер периода и группы, в которых расположен кремний
1) II, IV 2)III, IV 3) V, II 4) II, III
А 2.Общее количество электронов в атоме хлора
1) 8 2) 7 3) 35 4) 17
А 3.Заряд ядра атома магния и его относительная атомная масса:
1) +39; 12 2) + 12; 24 3) 24; + 19 4) 2; + 24 + 12; 24
А4. Неметаллические свойства у элементов А групп усиливаются
1) слева направо и в группах сверху вниз
2) справа налево и в группах сверху вниз
3) справа налево и в группах снизу вверх
4) слева направо и в группах снизу вверх
А5. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Na, Mg, Al, Si 2) Li, Be, B, C 3) P, S, Cl, Ar 4) F, O, N, C
А6. Число нейтронов в ядре атома 39K равно
1) 19
2) 20
3) 39
4) 58
А7. В каком ряду находятся только неметаллы:
1) S, O, N, Mg 2) N, O, F, Н 3) Fe, Cu, Na, H 4) Na, K, Cu, Ca
А8. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) Cl2, NH3, HCl 2) HBr, NO, Br2 3) H2S, H2O, S8 4) HI, H2O, PH3
А9. Кристаллическую структуру, подобную структуре алмаза, имеет
1) кремнезем SiО2 2) оксид натрия Na2O 3) оксид углерода (II) CO 4) белый фосфор Р4
А10. Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или подобный им катион NH4+) и гидроксид анионы OH –.
Б. Никаких других анионов, кроме OH–, основания не образуют.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
А11. Какая из приведенных реакций не относится к реакциям ионного обмена?
1) Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
2) KOH + HCl = KCl + H2O
3) 2KMnO4 = K2MnO4 + MnO2 + O2
4) Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2
А12. Только окислительные свойства проявляет
1) сульфид натрия 2) сера 3) серная кислота 4) сульфит калия
А13. На смещение химического равновесия в системе N2 + 3H2 ⇄ 2NH3 + Q
не оказывает влияния
1) понижение температуры 2) повышение давления
3) удаление аммиака из зоны реакции 4) применение катализатора
ГРУППА 306
ТЕМА2:




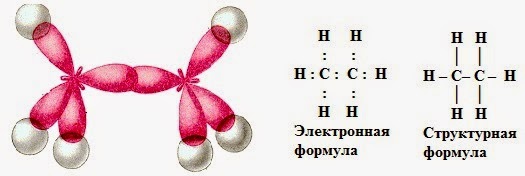






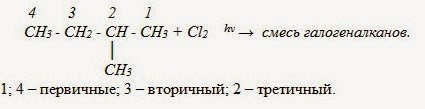
Комментариев нет:
Отправить комментарий