ВТОРНИК, 28.09.21 г. 206, 408, 401, 403
ГРУППА 206 БИОЛОГИЯ
ТЕМА: Биологическое окисление.
Биологическое окисление. Анаэробный этап клеточного дыхания.
И гетеротрофные, и автотрофные организмы способны получать энергию для обеспечения клеточных нужд (биосинтез различных веществ, транспорт и движение) путём окисления органических веществ. Для гетеротрофов окисление органических веществ является единственным способом получения энергии. Фотоавтотрофы используют энергию света для того, чтобы синтезировать сахара, а полученные сахара используются либо для синтеза других веществ и построения тела в ходе процессов анаболизма, либо как источник энергии в катаболизме. Фотосинтезирующие организмы расходуют свои запасы органических веществ случае отсутствия света, например, в темное время суток, а также в клетках, которые находятся в тех частях организма, куда не проникает свет.
суть биологического окисления
Окисление — это процесс отдачи веществом электронов окислителю. Окисление может происходить в ходе различных процессов:
- Отдача веществом только электронов. Такое окисление имеет место, например, при превращении
в составе цитохромов или же как реакция свободного железа при хемосинтезе. - Окислительно-восстановительные реакции органических веществ в клетках часто сопровождаются передачей не только электронов, но и атомов О или Н.
а) Поскольку атом О обладает большей электроотрицательностью, чем атом С, увеличение количества атомов кислорода в соединении считается окислением.
При этом степень окисления углерода в соединении увеличивается (электроны от него смещаются к кислороду,-заряд на атоме С увеличивается).
Пример — окисление альдегида до карбоновой кислоты.б) Поскольку связь С–Н гораздо менее полярная, чем С–О, степень окисления углерода в соединениях с большим количеством атомов Н меньше (менее положительная), чем в соединениях с меньшим количеством атомов Н (при наличии других электроотрицательных атомов — О, N…).
Поэтому окислением может называться отдача органическим веществом атомов водорода.
Пример — окисление спирта в альдегид.
переносчики водорода
Итак, биологическое окисление органических веществ часто происходит путем отдачи атомов водорода [H], то есть протонов
Таким образом, НАД переносит 2 электрона и 1 протон, второй протон выделяется в раствор. ФАД переносит 2 электрона и 2 протона.
Принимая на себя атомы водорода,
этапы окисления энергетических субстратов
Процесс катаболизма энергетических субстратов (органических веществ) протекает с выделением энергии. Он состоит из следующих этапов:
- Подготовительный этап идет в полости пищеварительной системы или — при внутриклеточном пищеварении — во вторичных лизосомах. При этом полимеры расщепляются на мономеры, которые можно перенести через мембрану в цитоплазму клеток (или сначала в кровь, а затем в тканевую жидкость и в цитоплазму). Расщепление катализируют литические ферменты. Например, амилазы и мальтазы расщепляют в тонком кишечнике крахмал до глюкозы.
Энергия на этом этапе выделяется в виде тепла, АТФ не образуется.
Основным источником энергии для многих клеток служит окисление глюкозы или других сахаров, поэтому рассматривается в первую очередь механизм окисления глюкозы, хотя и другие вещества могут окисляться с целью получения энергии (аминокислоты, жирные кислоты…).
Внутриклеточное окисление глюкозы включает два этапа:
а) анаэробный этап в цитоплазме — гликолиз. У анаэробов на этом окисление глюкозы заканчивается, так как нет молекулярного кислорода для дальнейшего окисления;
б) аэробный этап в митохондриях при участии молекулярного кислорода.
гликолиз
Первый этап внутриклеточного окисления углеводов осуществляется без участия кислорода и называется гликолиз (от «гликис» — сладкий, «лизис» — распад). Он происходит в цитоплазме.
На первых этапах гликолиза тратится две молекулы АТФ на фосфорилирование 1 молекулы сахара. Образующаяся гексоза (С6), несущая два остатка фосфорной кислоты, распадается на две фосфорилированные триозы (2*С3). Затем происходит окисление фосфотриозы (фосфорилированного C3-сахара — «половинки» глюкозы) до фосфоглицериновой кислоты (ФГК). Это окисление осуществляется путем отнятия двух атомов водорода и переноса их на
Образовавшаяся ФГК превращается далее в пировиноградную кислоту (ПВК), или пируват, при этом синтезируется еще две молекулы АТФ в расчете на 1 молекулу глюкозы. Таким образом, расщепление в гликолизе одной молекулы глюкозы дают в результате выигрыш в 2 молекулы АТФ. Пируват — это конечный продукт гликолиза.
В результате этого процесса в клетке будет накапливаться НАД∙Н, который необходимо снова превратить в
В условиях же бескислородной среды окисление НАДН до
Различают разные типы брожения:
а) Молочнокислое брожение. ПВК (пируват) превращается в молочную кислоту (лактат). Так происходит, например, при частых сокращениях мышц, когда поступление кислорода недостаточно, и основная часть АТФ получается за счет гликолиза. Накопление молочной кислоты является основным фактором усталости мышц. Аналогичный процесс происходит при росте ряда микроорганизмов в анаэробных условиях. Накапливающаяся при этом молочная кислота подавляет рост гнилостных бактерий и служит консервантом продуктов при приготовлении простокваши, йогурта, квашеной капусты, силоса на корм скоту.
б) Спиртовое брожение. Дрожжи на завершающем этапе гликолиза отщепляют от пировиноградной кислоты карбоксильную группу в форме углекислого газа, в результате чего образуется уксусный альдегид. Он восстанавливается путем переноса водородов с НАД∙Н до этилового спирта. На этом процессе основано пивоварение, виноделие, а также поднятие дрожжевого теста (за счет пузырьков образующегося углекислого газа).
ТЕМА: Генетическая информация. Удвоение ДНК.
1. ДНК — матрица для синтеза белков. Каким же образом в эритроцитах здорового человека образуются миллионы идентичных молекул гемоглобина, как правило, без единой ошибки в расположении аминокислот? Почему в эритроцитах больных серповидноклеточной анемией все молекулы гемоглобина имеют одну и ту же ошибку в одном и том же месте?
Для ответа на эти вопросы обратимся к примеру, с книгопечатанием. Учебник, который вы держите в руках, издан тиражом п экземпляров. Все п книг отпечатаны с одного шаблона — типографской матрицы, поэтому они совершенно одинаковы. Если бы в матрицу вкралась ошибка, то она была бы воспроизведена во всех экземплярах. Роль матрицы в клетках живых организмов выполняют молекулы ДНК. ДНК каждой клетки несет информацию не только о структурных белках, определяющих форму клетки (вспомните эритроцит), но и обо всех белках-ферментах, белках-гормонах и других белках.
Углеводы и липиды образуются в клетке в результате сложных химических реакций, каждая из которых катализируется своим белком-ферментом. Владея информацией о ферментах, ДНК программирует структуру и других органических соединений, а также управляет процессами их синтеза и расщепления.
Поскольку молекулы ДНК являются матрицами для синтеза всех белков, в ДНК заключена информация о структуре и деятельности клеток, о всех признаках каждой клетки и организма в целом.
Каждый белок представлен одной или несколькими полимерными цепями. Участок молекулы ДНК, служащий матрицей для синтеза одной полипептидной цепи, т. е. в большинстве случаев одного белка, называют геном. Каждая молекула ДНК содержит множество разных генов. Всю информацию, заключенную в молекулах ДНК, называют генетической. Идея о том, что генетическая информация записана на молекулярном уровне и что синтез белков идет по матричному принципу, впервые была сформулирована еще в 20-х годах выдающимся отечественным биологом Н. К. Кольцовым.
2. Удвоение ДНК. Молекулы ДНК обладают поразительным свойством, не присущим ни одной другой из известных молекул, — способностью к удвоению. Что представляет собой процесс удвоения? Вы помните, что двойная спираль ДНК построена по принципу комплементарности. Этот же принцип лежит в основе удвоения молекул ДНК. С помощью специальных ферментов водородные связи, скрепляющие нити ДНК, разрываются, нити расходятся, и к каждому нуклеотиду каждой из этих нитей последовательно пристраиваются комплементарные нуклеотиды. Разошедшиеся нити исходной (материнской) молекулы ДНК являются матричными — они задают порядок расположения нуклеотидов во вновь синтезируемой цепи. В результате действия сложного набора ферментов происходит соединение нуклеотидов друг с другом. При этом образуются новые нити ДНК, комплементарные каждой из разошедшихся цепей. Таким образом, в результате удвоения создаются две двойные спирали ДНК (дочерние молекулы), каждая из них имеет одну нить, полученную от материнской молекулы, и одну нить, синтезированную вновь.
Дочерние молекулы ДНК ничем не отличаются друг от друга и от материнской молекулы. При делении клетки дочерние молекулы ДНК расходятся по двум образующимся клеткам, каждая из которых вследствие этого будет иметь ту же информацию, которая содержалась в материнской клетке. Так как гены — это участки молекул ДНК, то две дочерние клетки, образующиеся при делении, имеют одинаковые гены.
Каждая клетка многоклеточного организма возникает из одной зародышевой клетки в результате многократных делений, поэтому все клетки организма имеют одинаковый набор генов. Случайно возникшая ошибка в гене зародышевой клетки будет воспроизведена в генах миллионов ее потомков. Вот почему все эритроциты больного серповидноклеточной анемией имеют одинаково «испорченный» гемоглобин. Дети, больные анемией, получают «испорченный» ген от родителей через их половые клетки. Информация, заключенная в ДНК клеток (генетическая информация), передается не только из клетки в клетку, но и от родителей к детям. Ген является единицей генетической, или наследственной, информации.
ГРУППА 408 БИОЛОГИЯ
ТЕМА: АТФ и другие органические соединения клетки.
клетки
1. Какие органические вещества вы знаете? 2. Какие витамины вам известны? Какова их роль? 3. Какие виды энергии вам известны? 4. Почему для жизнедеятельности любого организма необходима энергия? |
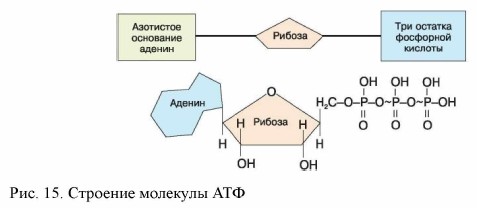
Аденозинтрифосфат (АТФ) - нуклеотид, состоящий из азотистого основания аденина, углевода рибозы и трёх остатков фосфорной кислоты (рис.), содержится в цитоплазме, митохондриях, пластидах и ядрах.
АТФ - неустойчивая структура. При отделении одного остатка фосфорной кислоты АТФ переходит в аденозиндифосфат (АДФ), если отделяется ещё один остаток фосфорной кислоты (что бывает крайне редко), то АДФ переходит в аденозинмонофосфат (АМФ). При отделении каждого остатка фосфорной кислоты освобождается 40 кДж энергии:
АТФ + Н2О → АДФ + Н3РО4 + 40 кДж,
АДФ + Н2О → АМФ + Н3РО4 + 40 кДж.
Связь между остатками фосфорной кислоты называют макроэргической (она обозначается символом ~), так как при её разрыве выделяется почти в четыре раза больше энергии, чем при расщеплении других химических связей (рис. ).
АТФ - универсальный источник энергии для всех реакций, протекающих в клетке.
Витамины (от лат. vita - жизнь) - сложные биоорганические соединения, необходимые в малых количествах для нормальной жизнедеятельности организмов. Как недостаток, так и избыток витаминов может привести к серьёзным нарушениям многих физиологических функций в организме.
В отличие от других органических веществ, витамины не используются в качестве источника энергии или строительного материала. Некоторые витамины могут синтезироваться самим организмом (например, бактерии способны образовывать практически все витамины). Другие витамины поступают в организм с пищей.
Витамины принято обозначать буквами латинского алфавита. В основу современной классификации витаминов положена их способность растворяться в воде и жирах. Различают жирорастворимые (A, D, Е и К) и водорастворимые (В, С, РР и др.) витамины.
Кроме перечисленных выше органических соединений (углеводы, липиды, белки, нуклеиновые кислоты, витамины), в любой клетке всегда есть много других органических веществ. Они являются промежуточными или конечными продуктами биосинтеза и распада.
Новые понятия
Аденозинтрифосфат (АТФ). Аденозиндифосфат (АДФ). Аденозинмонофосфат (АМФ). Макроэргическая связь. Витамины жирорастворимые и водорастворимые
Ответьте на вопросы
1. Какое строение имеет молекула АТФ? 2. Какую функцию выполняет АТФ? 3. Какие связи называются макроэргическими? 4. Какую роль выполняют в организме витамины?
ТЕМА: Клетка – элементарная единица живого.
ОБЯЗАТЕЛЬНО ПРОСМОТРИТЕ ВИДЕО!
ГРУППА 401 ХИМИЯ
ТЕМА:Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).
Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).




- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
ГРУППА 403 ХИМИЯ
ТЕМА: Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).




- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
ТЕМА: Строение атома и периодический закон Д.И. Менделеева. Атом – сложная частица. Ядро (протоны и нейтроны) и электронная оболочка. Изотопы
ПОСМОТРИ ВИДЕО И СДЕЛАЙ ЗАПИСИ.

Комментариев нет:
Отправить комментарий