ПОНЕДЕЛЬНИК, 06.12.21г. 306, 308, 408, 301
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 306 ХИМИЯ 35,36
Тема :Фенол. Физические и химические свойства фенола. Взаимное влияние атомов в молекуле фенола: взаимодействие с гидроксидом натрия и азотной кислотой. Применение фенола на основе свойств.
СМОТРИМ ВИДЕО, КОНСПЕКТИРУЕМ, УЧИМ.
1. Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
- изомерия положения заместителей в бензольном кольце
- изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей
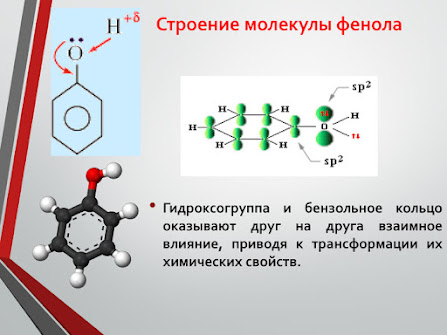
4. Строение молекулы
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
3. Красителей
4. Поверхностно-активных веществ
5. Антиоксидантов
6. Антисептиков
7. Взрывчатых веществ
8-
9. Химические свойства фенола (карболовой кислоты)
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
- С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
фенолят натрия
- Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол |
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
II. Свойства бензольного кольца
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с альдегидами. Например:
2). Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор
Тема: Альдегиды - органические вещества
Альдегиды - органические вещества, молекулы которых содержат карбонильную группу —![]() —, связанную с атомом водорода и углеводородным радикалом.
—, связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов ![]() или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой.
Кетоны - органические вещества, молекулы которых содержат карбонильную группу —![]() —, связанную с двумя углеводородными радикалами.
—, связанную с двумя углеводородными радикалами.
Общая формула кетонов ![]() или R—CO—R'.
или R—CO—R'.
Альдегиды и кетоны называются карбонильными соединениями, их общая формула - CnH2nO.
Изомеры и гомологи
| г о м о л о г и | HCHO метаналь (формальдегид, муравьиный альдегид) | ||
| CH3CHO этаналь (ацетальдегид, уксусный альдегид) | |||
| CH3CH2CHO пропаналь (пропионовый альдегид) | CH3—CO—CH3 пропанон (ацетон) | ||
| CH3CH2CH2CHO бутаналь (масляный альдегид) | 2-метилпропаналь | бутанон (метилэтилкетон) | |
| и з о м е р ы | |||
В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей.
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь ![]() поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд (![]() +) на атоме углерода этой группы, тем выше активность соединения.
+) на атоме углерода этой группы, тем выше активность соединения.
- Горение:2CH3CHO + 5O2
 4CO2 + 4H2O
4CO2 + 4H2O
2CH3COCH3 + 9O2 6CO2 + 6H2O
6CO2 + 6H2O - Присоединение (по двойной связи карбонильной группы).
В ряду HCHO RCHO
RCHO  RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):HCHO + H2 CH3OH
CH3OH
CH3—CO—CH3 + H2 CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. - Окисление:CH3CHO + Ag2O
 2Ag
2Ag + CH3COOH (реакция "серебряного зеркала" - качественная реакция)
+ CH3COOH (реакция "серебряного зеркала" - качественная реакция)
HCHO + 2Cu(OH)2 2H2O + Cu2O
2H2O + Cu2O + HCOOH (образуется красный осадок - качественная реакция)
+ HCOOH (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются. - Замещение атомов водорода в углеводородном радикале (замещение происходит в
 -положение, т. е. замещается атом водорода у 2-го атома углерода):
-положение, т. е. замещается атом водорода у 2-го атома углерода):3 2(  )
)1 CH3 —CH2 —CHO + Cl2  CH3—CHCl—CHO + HCl
CH3—CHCl—CHO + HClФормальдеги́д (от лат. formīca — «муравей»[4]) — органическое соединение, бесцветный газ с резким неприятным запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, контаминант, канцерогенен. В больших концентрациях ядовит.
Формальдегид — первый член гомологического ряда алифатических альдегидов, альдегид метанола и муравьиной кислоты.
Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок).
ТЕМА: Альдегиды. Понятие об альдегидах. Альдегидная группа как функциональная.
ГРУППА 408 ХИМИЯ 17
ГРУППА 308 ХИМИЯ 33,34 ТЕМА:Аминокислоты, их строение, изомерия и свойства. Аминокислоты как амфотерные органические соединения.ТЕМА:Генетическая связь аминокислот с другими классами органических соединений.
|
Применение ацетилена на основе свойств.
.
АЛКИНЫ. АЦЕТИЛЕН. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА: ГОРЕНИЕ, ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ, ПРИСОЕДИНЕНИЕ ХЛОРОВОДОРОДА И ГИДРАТАЦИЯ. ПРИМЕНЕНИЕ АЦЕТИЛЕНА НА ОСНОВЕ СВОЙСТВ.
На этом уроке вы сможете самостоятельно изучить тему «Алкины. Строение, номенклатура, изомерия, физические свойства, получение». В ходе урока вы узнаете о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомитесь с физическими свойствами алкинов, особенностями их строения.
НОМЕНКЛАТУРА АЛКИНОВ
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
 | |
| ацетилен (этин) | бутин-1 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.

3,6-диметилгептадиин-1,4

Рис. 1. Шаростержневая модель ацетилена
СТРОЕНИЕ АЛКИНОВ
Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.

Рис. 2. Образование тройной связи в молекуле ацетилена
3. ИЗОМЕРИЯ АЛКИНОВ
1. Изомерия скелета
2. Изомерия положения тройной связи
| бутин-1 | бутин-2 |
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
 |  | |
| бутин-1 | бутадиен-1,3 | циклобутен |
Алкины не обладают геометрической изомерией.
4. ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ АЛКИНОВ
Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества.
Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен.
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4![]() С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + Н2О ¾¾¾→ Сa(OH)2 + C2H2.
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:

1. Реакции гидрирования и галогенирования
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
![]()
![]()
Электрофильное присоединение
Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора).
Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью.
2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛКИНЫ
1. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.


2. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
![]()
3. РЕАКЦИЯ КУЧЕРОВА
3. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.


4. ПОЛУЧЕНИЕ АЦЕТИЛЕНА В ЛАБОРАТОРИИ
Кислотные свойства алкинов
Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом.
![]()
Ацетиленид меди – темно-красный, а ацетиленид серебра – желтый или белый. Это можно использовать при определении алкинов с концевой тройной связью.
Окисление алкинов
1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью. Рис. 1.
5HCºCR + 8KMnO4 + 24HCl ®5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2. На воздухе алкины горят коптящим пламенем:
2С2Н2 + 5О2 = 4СО2 + 2Н2О.

Рис. 1. Обесцвечивание КМnO4
Применение алкинов
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Рис. 2, 3.

Рис. 2. Ацетиленовая горелка

Рис. 3. Сварка и резка металлов
Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
Подведение итога урока
На этом уроке вы изучили тему «Алкины. Химические свойства и применение». Вы смогли узнать, что представляют собой алкины и какими химическими свойствами характеризуется этот класс соединений. Вы узнали о том, как свойства алкинов влияют на их практическое применение.









Комментариев нет:
Отправить комментарий