03.11.22 г. ЧЕТВЕРГ. 508, 405,405, 303
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи (ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)
Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 508 ХИМИЯ 9,10
ТЕМА 9: Алканы. Строение, номенклатура.
Алканы относятся к насыщенным углеводородам, то есть к органическим соединениям, в составе которых содержаться только одинарные С – С связи.
Наиболее часто в природе встречается метан. Он представляет собой бесцветный газ, который легче воздуха, не имеет запаха. Метан образуется в природных условиях при разложении без доступа воздуха остатков растительных и животных организмов. Метан ещё называют болотным газом из-за того, что в небольшом количестве он выделяется в заболоченных местах. Больше всего метана в природном газе, там его содержание достигает 95 %. Метан вместе с этаном, пропаном и бутаном содержится в попутных нефтяных газах и в угольных пластах.
Высшие алканы входят в состав пчелиного воска, восковых покрытий листьев, плодов и семян растений, они встречаются также в виде озокерита.
Все насыщенные углеводороды образуют ряд, в котором любой член ряда отличается на одну или несколько групп – СН2 –, которая называется гомологической разностью. Сам ряд углеводородов называется гомологическим рядом, а члены гомологического ряда – гомологами. Первые представить этого ряда – метан, второй – этан, третий член ряда – пропан, а четвёртый – бутан. Состав гомологического ряда алканов можно выразить общей формулой CnH2n+2. Буква n показывает число атомов углерода, которые содержатся в молекуле конкретного углеводорода. Например, в молекуле гептана содержится 7 атомов углерода, значит его молекулярная формула С7Н16.
Рассмотрим электронное и пространственное строение алканов. Например, молекулярная формула метана СН4. Связи между атомом углерода и водорода являются равноценными и называются σ-связями. В электронной формуле метана валентные связывающие электроны показаны в виде точек. Каждая химическая связь изображается чёрточкой при записи структурной формулы.
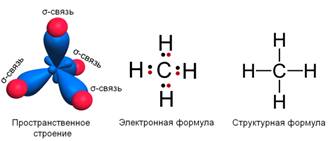
Установлено, что молекула метана имеет тетраэдрическое строение. В центре тетраэдра – атом углерода, а атомы водорода находятся в вершинах тетраэдра. Такое расположение связей обусловлено взаимным отталкиванием электронных облаков связей С – Н.

Пространственное строение других алканов аналогичное. Например, у пропана такое же тетраэдрическое строение, углы между связями 109028´, поэтому атомы углерода находятся не по прямой линии, а зигзагообразно. Особенностью одинарной связи между атомами углерода является возможность свободного вращения атомов вокруг этой связи, поэтому углеродная цепь алканов может принимать различную форму. Длина этой углерод-углеродной связи С – С в молекуле алканов равна 0,154 нм.

Алканы могут иметь неразветвлённое и разветвлённое строение. Названия алканов по Международной номенклатуре образуются добавлением суффинка – ан к греческим названиям чисел, которые показывают число атомов углерода в составе молекулы. Первые четыре представителя гомологического ряда алканов имеют тривиальные названия: с одним атомом углерода – метан, двумя – этан, тремя – пропан и четырьмя – бутан.
Радикалы, или алкильные группы имеют названия такие же, как названия алканов, только суффикс –ан заменяется на суффикс –ил. Например, радикал – СН3 называется метил, с двумя атомами углерода – этил, с тремя – пропил или изопропил и так далее.
Для того, чтобы назвать алкан нужно выбрать самую длинную цепь, нумерацию начинают с того конца, где ближе заместители. Затем называют заместители в алфавитном порядке.
Назовём следующий углеводород.

Определяем слева или справа начинать отсчёт. Заместители ближе с правой стороны, поэтому отсчёт начинаем справа налево. От третьего атома углерода отходят два одинаковых заместителя. Поэтому название этого углеводорода будет 3,3-диметилгексан.
Приведём ещё один более сложный пример названия алкана.

Первое, что нужно сделать – это найти главную цепь, то есть цепь, имеющую самое большое число атомов углерода. Предположим, начнём отсчёт слева. Главная цепь содержит 10 атомов углерода. Теперь попробуем пронумеровать справа. Главная цепь и в этом случае содержит 10 атомов углерода. Выбираем за главную цепь ту, которая содержит большее число разветвлений. Обозначим заместители. Их всего 5. У нас есть заместители, которые называются метил, этил и пропил. Слева заместители отходят от третьего атома углерода, справа – от второго. Приоритет отдаётся тому направлению, где ближе первое разветвление. Значит, нумерацию начинаем справа. Согласно правилам современной номенклатуры, названия радикалам нужно давать в том порядке, в каком они находятся по алфавиту. Получается, что первым мы будим называть метил, потом, пропил, в последнюю очередь – этил. Так как метил не один, а их три, то название углеводорода будет следующим: 2,6,8-триметил, далее у пятого атома углерода радикал пропил, поэтому 5-пропил, 8-этилдекан.

Для алканов, как и для других органических соединений, характерно явление изомерии, то есть явление существования различных соединений, имеющих один и тот же качественный и количественный состав, но разное строение.
Для насыщенных углеводородов – алканов изомерия начинается с бутана. Например, у бутана и изобутана одна и та же молекулярная формула – С4Н10, но разное химическое строение. Так, в бутане с неразветвлённой цепью атомов центральный атом связан с двумя атомами углерода, а в изобутане, где разветвлённая цепь атомов, центральный атом связан с тремя атомами углерода. Поэтому бутан и изобутан являются изомерами. Кроме того, что у этих веществ различное строение, они ещё имеют и различные свойства.

Различают изомерию структурную и пространственную. Одним из видов структурной изомерии является изомерия углеродного скелета. Так, у пентана есть 3 изомера. Это нормальный пентан, который имеет неразветвлённую цепь атомов углерода, 2-метилбутан, или изопентан, а также 2,2-диметилпропан, или неопентан.

Если посмотреть гомологический ряд алканов, то можно увидеть, что первые четыре члена этого ряда являются газами и имеют температуру кипения ниже комнатной. Алканы с С5 – С15 – жидкости, а алканы, которые имеют 16 и более атомов углерода – твёрдые вещества. С увеличение относительной молекулярной массы температуры плавления и кипения увеличиваются. Алканы практически не растворимы в воде.
Таким образом, общая формула алканов CnH2n+2. Длина С – С связи равна 0,154 нм. Для метана и его гомологов характерно тетраэдрическое строение. Основу названия алканов определяет самая длинная цепь атомов углерода, начиная с того конца, где ближе находится заместитель. Для алканов характерна изомерия углеродного скелета.
ТЕМА10:Физические и химические свойства алканов.
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование. Применение алканов на основе свойств. Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: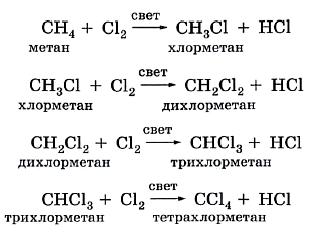
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь ПОЗЖЕ .
Таблица «Предельные углеводороды
(алканы, парафины)»

ГРУППА 405 ХИМИЯ 28,29
ТЕМА 28,29 Применение ацетилена на основе свойств.Межклассовая изомерия с алкадиенами.
В условиях атмосферного давления и нормальной температуры ацетилен представляет собой бесцветный газ.
Если температура опускается до значения -85 градусов и ниже, то это соединение переходит в другое состояние – твердое. При этом образуются кристаллы.
Следует отметить, что в жидком и твердом состоянии ацетилен может легко взрываться под воздействием трения или при ударе (гидравлическом или механическом). Именно это свойство во многом обусловливает его область применения.
Реакции горения ацетилена происходят в присутствии кислорода. В результате данного процесса возникает пламя, характеризующееся самыми высокими показателями температуры (3150 градусов) по сравнению с другими видами горючего. Основным способом получения ацетилена является реакция, в которой взаимодействуют карбид кальция и вода.
Данный процесс протекает при показателях температуры около 2000 градусов и является эндотермическим. Существует такое понятие, как выход ацетилена. Это такое его количество, которое выделяется в результате разложения 1 кг карбида кальция. ГОСТ 1460-56 устанавливает конкретные значения данной величины, которая находится в прямой зависимости от степени грануляции исходного вещества. Таким образом, следствием относительно небольшого размера частиц карбида кальция является снижение выхода ацетилена.
Данная закономерность является следствием наличия в мелких частицах карбида посторонних примесей, например оксида кальция.
Существуют и другие, менее громоздкие, дорогие и энергозатратные способы получения ацетилена. Например, реакция термоокислительного пиролиза метана из природного газа; разложение нефти, керосина и других видов горючего путем электропиролиза.
Хранение и транспортировка Все способы хранения и транспортировки предусматривают использование баллонов. Они заполняются специальной массой пористой консистенции. Ее пропитывают ацетоном, который хорошо растворяет ацетилен.
Применение данного способа позволяет значительно увеличить наполняемость баллона ацетилена и, что немаловажно, понижает его взрывоопасность. Длительное соприкосновение ацетилена с такими металлами, как медь и серебро, может привести к повышению его взрывоопасности.
Следовательно, недопустимо использование материалов, которые могут содержать эти металлы, например в вентилях. Как правило, баллоны должны иметь специальные вентили, предназначенные именно для хранения ацетилена.
Полного использования всей емкости баллона можно достигнуть, храня пустые емкости так, чтобы ацетон был распределен по всему объему баллона. А это возможно только в горизонтальном положении.
Наполнение баллона должно происходить очень медленно, что важно для соблюдения условий химической реакции растворения ацетилена в ацетоне, а в частности ее скорости.
Преимущества растворенного ацетилена Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %.
Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах. Основные области применения ацетилена Сварка и резка металлов.
Использование в качестве источника яркого, белого света.
В данном случае речь идет об ацетилене, получаемом путем взаимодействия карбида кальция и воды. При этом используются автономные светильники.
Производство взрывчатых веществ. Получение других соединений и материалов, которыми являются уксусная кислота, этиловый спирт, растворители, пластические массы, каучук, ароматические углеводороды. Ацетилен: применение в строительстве и промышленности Автогенные и сварочные работы сопровождают практически все этапы строительства.
Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.
- Изомерия положения тройной связи (начиная с С4Н6):
- 2. Изомерия углеродного скелета (начиная с С5Н8):
- Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом - вдоль линии связи.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: HC≡CH + Ag2O → AgC≡Cag + H2O (1); H-C(O)H + 2 Ag2O → CO2 + H2O + 4Ag (2). Рассчитаем количество вещества оксида серебра (I): n = m / M; n(Ag2O) = m(Ag2O) / M(Ag2O); M(Ag2O) = 232 г/моль; n(Ag2O) = 69,6 / 232 = 0,3 моль. По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль. Найдем массы веществ, составляющих смесь: M(HC≡CH) = 26 г/моль; M(H-C(O)H) = 30 г/моль; m(HC≡CH) = 0,1 × 26 = 2,6 г; m(H-C(O)H) = 0,1 × 30 = 3 г. |
| Ответ | Масса ацетилена равна 2,6 г, формальдегида – 3 г. |
ГРУППА 405 экология 21
ТЕМА 21: РОСТ ЧИСЛЕННОСТИ НАСЕЛЕНИЯ.
ОТКРОЙТЕ УЧЕБНИК ЭКОЛОГИИ (это ссылка на электронный учебник.) ПАРАГРАФ 31- ЧИТАТЬ, СТР. 205, ВОПРОС 1,2 ПИСЬМЕННО ОТВЕТИТЬ И ПРИСЛАТЬ.
ГРУППА 303 ЭКОЛОГИЯ 10,11
Тема:10 ПОЧВЕННЫЕ РЕСУРСЫ.
ПАРАГРАФ 38 ЧИТАТЬ, ОТВЕТИТЬ ПИСЬМЕННО НА ВОПРОС 3 СТР.259.
ТЕМА 11 : СОВРЕМЕННОЕ СОСТОЯНИЕ И ОХРАНА РАСТЕНИЙ.
ПРОЧИТАТЬ ПАРАГРАФ 39, РАССМОТРИТЕ РИСУНКИ, ПРОЧТИТЕ ДОПОЛНИТЕЛЬНУЮ ИНФОРМАЦИЮ.
Комментариев нет:
Отправить комментарий