ЧЕТВЕРГ 19.11.20 г. ГР. 303
ТЕМА: Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Массовая доля растворенного вещества
Существуют различные способы выражения концентрации растворённого вещества в растворе, мы познакомимся с массовой долей растворённого вещества (процентной концентрацией). I. Массовая доля растворённого вещества wрастворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора : mраствора = mрастворённого вещества + mрастворителя Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г. ЗАПОМНИТЕ! Пример решения задачи: Решение:
«Вычисление массовой доли растворённого вещества» Задача: Сахар массой 12,5г растворили в 112,5г воды. Определите массовую долю сахара в полученном растворе.
|
Основные термины:
Массовая доля – отношение массы растворенного вещества к общей массе раствора.
Объемная доля – отношение объема данного вещества к общему объему смеси.
1. Среди приведенных объектов выберите самый маленький по размеру:
а) бактерия;
б) молекула;
в) маковое зернышко;
г) песчинка.
2. В каком ряду все перечисленные вещества относятся к простым?
а) мел, углерод, озон;
б) алмаз, кислород, гранит;
в) сера, фосфор, озон;
г) крахмал, водород, железо.
3. Очень важной для живой природы особенностью физических свойств воды является то, что:
а) температура кипения воды равна 100º С;
б) плотность жидкой воды выше плотности льда;
в) температура замерзания воды равна 0º С;
г) вода обладает очень низкой электропроводностью.
4. Соединений, содержащих только атомы водорода и кислорода:
а) не известно ни одного;
б) известно только одно;
в) известно несколько;
г) известно огромное количество.
5. При взаимодействии кислорода с металлами:
а) образуются соли;
б) выделяется озон;
в) образующиеся соединения всегда являются оксидами;
г) образующиеся соединения не всегда являются оксидами.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).
Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
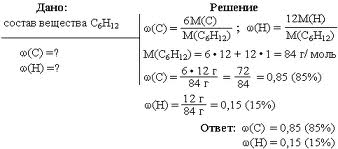
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5.
Рис.4. Задача на нахождение массовой доли.
Рис.5. Задача на нахождение массовой доли (в процентах).
Объемная доля.
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6):
Рис. 6. Объемная доля.
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7).
Рис.7. Объемная доля благородных газов в воздухе.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
Давайте посмотрим, как решать задачи на нахождение объемной доли (рисунок 8).
Рис.8. Задача на нахождение объемной доли.
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.




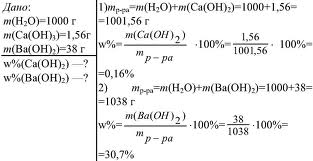
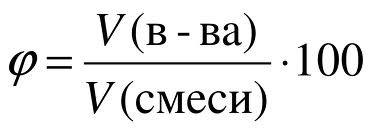


Комментариев нет:
Отправить комментарий