ПОНЕДЕЛЬНИК, 04.10.21 г. 306, 308, 408, 301
ГРУППА 306 ХИМИЯ 9,10
ТЕМА: КОНТРОЛЬНАЯ РАБОТА
(РЕШИТЕ ЗАДАЧИ, АНАЛОГИЧНЫЕ С РЕШЕНИЕМ СМОТРИТЕ ВО ВКЛАДКЕ "РЕШАЕМ ЗАДАЧИ")
1. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
2. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
3. Из образца горной породы массой 25 г, содержащей минерал аргентит
Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г; m = 25 г.
Найти: ω(Ag2S) =?
ТЕМА: Предмет органической химии. Природные, искусственные и синтетические органические вещества. Сравнение органических веществ с неорганическими.
Химики разделяли все вещества в зависимости от источника их получения на минеральные (неорганические), животные и растительные (органические).
Долгое время считалось, что для получения органических веществ нужна особенная «жизненная сила» - vis vitalis, которая действует только в живых организмах, а химики способны лишь выделять органические вещества из продуктов жизнедеятельности , но не могут синтезировать их. Поэтому шведский химик Й.Я. Берцелиус определил органическую химию как химию растительных или животных веществ, образующихся под влиянием «жизненной силы».Именно Берцелиус ввел понятие органические вещества и органическая химия.
Развитие химии привело к накоплению большого количества фактов и к краху учения о «жизненной силе» -витализма. Немецкий ученый Ф. Вёлер в 1824 г. осуществил первый синтез органических веществ - получил щавелевую кислоту путем взаимодействия двух неорганических веществ – дициана и воды:
А в 1828 г. Вёлер, нагревая водный раствор неорганического вещества цианата аммония, получил мочевину – продут жизнедеятельности живых организмов
Изумлённый таким результатом, Вёлер написал Берцелиусу: «Должен сказать вам, что я умею приготовить мочевину, не нуждаясь не в почке, ни в живом организме вообще»
В последние годы блестящие синтезы анилина Г. Кольбе и Э. Франклендом (1842), жира М. Берло (1854), сахаристых веществ А.Бутлеровым (1861) и др. окончательно похоронили миф о «жизненной силе».
Появилось классическое определение К. Шорлеммера, не потерявшее своего значения и более 120 лет спустя:
"Органическая химия есть химия углеводородов и их производных, т.е. продуктов, образующихся при замене водорода другими атомами или группами атомов".
Сейчас органическую химию чаще всего называют химией соединений углерода. Почему же из более чем ста элементов Периодической системы Д. И. Менделеева природа именно углерод положила в основу всего живого? Ответ на этот вопрос неоднозначен. Многое вам станет понятно, когда вы рассмотрите строение атома углерода и поймете слова Д. И. Менделеева, сказанные им в «Основах химии» об этом замечательном элементе: «Углерод встречается в природе как в свободном, так и в соединительном состоянии, в весьма различных формах и видах… Способность атомов углерода соединяться между собой и давать сложные частицы проявляется во всех углеродистых соединениях… Ни в одном из элементов… способности к усложнению не развито в такой степени, как в углероде… Ни одна пара элементов не дает столь много соединений, как углерод с водородом».
Многочисленные связи атомов углерода между собой и с атомами других элементов (водорода, кислорода, азота, серы, фосфора), входящих в состав органических веществ, могут разрушаться под влиянием природных факторов. Поэтому углерод совершает непрерывный круговорот в природе: из атмосферы (углекислый газ) – в растения (фотосинтез), из растений – в животные организмы, из живого – в мертвое, из мертвого – в живое…(рис 1).
Органические вещества имеют ряд особенностей, которые отличают их от неорганических веществ:
1. Неорганических веществ насчитывается немногим более 100 тыс., тогда как органических – почти 18млн (табл. 1).
Таблица 1. Рост числа известных органических соединений
Год | Число известных органических соединений |
1880 | 12 000 |
1910 | 150 000 |
1940 | 500 000 |
1960 | 1 000000 |
1970 | 2 000000 |
1980 | 5 500 000 |
2000 | 18 000000 |
2. В состав всех органических веществ входят углерод и водород, поэтому большинство из них горючи и при горении обязательно образуют углекислый газ и воду.
3. Органические вещества построены более сложно, чем неорганические, и многие из них имеют огромную молекулярную массу, например те, благодаря которым происходят жизненные процессы: белки, жиры, углеводороды, нуклеиновые кислоты и. т. д.
4. Органические вещества можно расположить в ряд сходных по составу, строению и свойствам – гомологов
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическими свойствам, где каждый член отличается от предыдущего на гомологическую разность СН2
5. Для органических веществ характерной является изомерия, очень редко встречающаяся среди неорганических веществ. Вспомните примеры изомеров, с которыми вы знакомились в 9 классе. В чем причины различий в свойствах изомеров?
Изомерия – это явление существования разных веществ –изомеров с одинаковым качественным и количественным составом, т.е. одинаковой молекулярной формулой.
Величайшим обобщением знаний о неорганических веществах является Периодический закон и Периодическая система элементов Д. И. Менделеева. Для органических веществ аналогом такого обобщения служат теория строения органических соединений А. М. Бутлерова. Вспомните, что Бутлеров понимал под химическим строением. Сформулируйте основные положения этой теории.
Для количественной характеристики способности атомов одного химического элемента соединяться с определенным числом атомов другого химического элемента в неорганической химии, где большинство веществ имеет немолекулярное строение, применяют понятие «степень окисления». В органической химии, где большинство соединений имеет молекулярное строение, используют понятие «валентность». Вспомните, что означают эти понятия, сравните их.
Велико значение органической химии в нашей жизни. В любом организме, в любой момент протекает множество превращений одних органических веществ в другие. Поэтому без знаний органической химии невозможно понять, как осуществляется функционирование систем, образующих живой организм, т.е. сложно понимание биологии и медицины.
С помощью органического синтеза получают разнообразные органические вещества: искусственные и синтетические волокна, каучуки, пластмассы, красители, пестициды (что это такое?), синтетические витамины, гормоны, лекарства и.т.д.
Многие современные продукты и материалы, без которых мы не можем обходиться, являются органическими веществами (табл. 2)
Развитие биотехнологии, т.е. получения органических веществ не из живых организмов, а из клеточных культур (например, получение белков с помощью дрожжей на основе углеводородного сырья), генной инженерии, т.е. синтеза важнейших соединений белковой природы (например, синтез инсулина, интерферона), создание новых видов высокопродуктивных организмов было бы невозможно без достижения органической химии.
Таблица 2. Некоторые природные и синтетические вещества.
Природные вещества | Синтетические вещества |
Белки, углеводы, жиры | Пищевые добавки, стимуляторы |
Витамины | Синтетические витамины |
Ферменты | Катализаторы |
Гормоны | Гормональные препараты |
Лекарства растительного и природного происхождения | Синтетические лекарства |
ГРУППА 308 ХИМИЯ 9,10
ТЕМА:Строение и свойства сложных эфиров, их применение.
Строение и свойства сложных эфиров, их применение
На данном уроке будет рассмотрена тема «Производные карбоновых кислот. Сложные эфиры». Благодаря этой теме, вы сможете познакомиться с производными карбоновых кислот. Также вы изучите самые важные функциональные производные карбоновых кислот – сложные эфиры. Рассмотрите их состав, некоторые свойства, формирование названий и сферы их применения в жизни.
I. Состав и строение сложных эфиров
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR).
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', где R и R' – углеводородные радикалы.

II. Физические свойства и нахождение сложных эфиров в природе
- Летучие, бесцветные жидкости
- Плохо растворимы в воде
- Чаще с приятным запахом
- Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах.
Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Аромат. Структурная формула. | Название сложного эфира |
Яблоко  | Этиловый эфир 2-метилбутановой кислоты
|
Вишня  | Амиловый эфир муравьиной кислоты
|
Груша  | Изоамиловый эфир уксусной кислоты
|
Ананас  | Этиловый эфир масляной кислоты (этилбутират) |
Банан  | Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
Жасмин  | Бензиловый эфир уксусной (бензилацетат)
|
Запахи эфиров:
Рис. 1.
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами.
Сравнение температуры кипения эфиров
III. Номенклатура сложных эфиров
Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Названия по ИЮПАК выделены жирным шрифтом:
H–COO–C2H5 | CH3–COO–CH3–CH3 | CH2CH2–COO–C2H5 |
Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты | Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты | Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |

IV. Применение
- В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
V. Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR' + H2O (H+)↔ RCOOH + R'OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
VI. Тренажеры
Тренажер №1: “Реакция этерификации”
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
ГРУППА 408 ХИМИЯ 10
ТЕМА: Алканы. Строение, номенклатура.
Алканы относятся к насыщенным углеводородам, то есть к органическим соединениям, в составе которых содержаться только одинарные С – С связи.
Наиболее часто в природе встречается метан. Он представляет собой бесцветный газ, который легче воздуха, не имеет запаха. Метан образуется в природных условиях при разложении без доступа воздуха остатков растительных и животных организмов. Метан ещё называют болотным газом из-за того, что в небольшом количестве он выделяется в заболоченных местах. Больше всего метана в природном газе, там его содержание достигает 95 %. Метан вместе с этаном, пропаном и бутаном содержится в попутных нефтяных газах и в угольных пластах.
Высшие алканы входят в состав пчелиного воска, восковых покрытий листьев, плодов и семян растений, они встречаются также в виде озокерита.
Все насыщенные углеводороды образуют ряд, в котором любой член ряда отличается на одну или несколько групп – СН2 –, которая называется гомологической разностью. Сам ряд углеводородов называется гомологическим рядом, а члены гомологического ряда – гомологами. Первые представить этого ряда – метан, второй – этан, третий член ряда – пропан, а четвёртый – бутан. Состав гомологического ряда алканов можно выразить общей формулой CnH2n+2. Буква n показывает число атомов углерода, которые содержатся в молекуле конкретного углеводорода. Например, в молекуле гептана содержится 7 атомов углерода, значит его молекулярная формула С7Н16.
Рассмотрим электронное и пространственное строение алканов. Например, молекулярная формула метана СН4. Связи между атомом углерода и водорода являются равноценными и называются σ-связями. В электронной формуле метана валентные связывающие электроны показаны в виде точек. Каждая химическая связь изображается чёрточкой при записи структурной формулы.
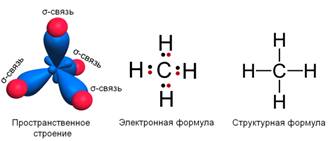
Установлено, что молекула метана имеет тетраэдрическое строение. В центре тетраэдра – атом углерода, а атомы водорода находятся в вершинах тетраэдра. Такое расположение связей обусловлено взаимным отталкиванием электронных облаков связей С – Н.

Пространственное строение других алканов аналогичное. Например, у пропана такое же тетраэдрическое строение, углы между связями 109028´, поэтому атомы углерода находятся не по прямой линии, а зигзагообразно. Особенностью одинарной связи между атомами углерода является возможность свободного вращения атомов вокруг этой связи, поэтому углеродная цепь алканов может принимать различную форму. Длина этой углерод-углеродной связи С – С в молекуле алканов равна 0,154 нм.

Алканы могут иметь неразветвлённое и разветвлённое строение. Названия алканов по Международной номенклатуре образуются добавлением суффинка – ан к греческим названиям чисел, которые показывают число атомов углерода в составе молекулы. Первые четыре представителя гомологического ряда алканов имеют тривиальные названия: с одним атомом углерода – метан, двумя – этан, тремя – пропан и четырьмя – бутан.
Радикалы, или алкильные группы имеют названия такие же, как названия алканов, только суффикс –ан заменяется на суффикс –ил. Например, радикал – СН3 называется метил, с двумя атомами углерода – этил, с тремя – пропил или изопропил и так далее.
Для того, чтобы назвать алкан нужно выбрать самую длинную цепь, нумерацию начинают с того конца, где ближе заместители. Затем называют заместители в алфавитном порядке.
Назовём следующий углеводород.

Определяем слева или справа начинать отсчёт. Заместители ближе с правой стороны, поэтому отсчёт начинаем справа налево. От третьего атома углерода отходят два одинаковых заместителя. Поэтому название этого углеводорода будет 3,3-диметилгексан.
Приведём ещё один более сложный пример названия алкана.

Первое, что нужно сделать – это найти главную цепь, то есть цепь, имеющую самое большое число атомов углерода. Предположим, начнём отсчёт слева. Главная цепь содержит 10 атомов углерода. Теперь попробуем пронумеровать справа. Главная цепь и в этом случае содержит 10 атомов углерода. Выбираем за главную цепь ту, которая содержит большее число разветвлений. Обозначим заместители. Их всего 5. У нас есть заместители, которые называются метил, этил и пропил. Слева заместители отходят от третьего атома углерода, справа – от второго. Приоритет отдаётся тому направлению, где ближе первое разветвление. Значит, нумерацию начинаем справа. Согласно правилам современной номенклатуры, названия радикалам нужно давать в том порядке, в каком они находятся по алфавиту. Получается, что первым мы будим называть метил, потом, пропил, в последнюю очередь – этил. Так как метил не один, а их три, то название углеводорода будет следующим: 2,6,8-триметил, далее у пятого атома углерода радикал пропил, поэтому 5-пропил, 8-этилдекан.

Для алканов, как и для других органических соединений, характерно явление изомерии, то есть явление существования различных соединений, имеющих один и тот же качественный и количественный состав, но разное строение.
Для насыщенных углеводородов – алканов изомерия начинается с бутана. Например, у бутана и изобутана одна и та же молекулярная формула – С4Н10, но разное химическое строение. Так, в бутане с неразветвлённой цепью атомов центральный атом связан с двумя атомами углерода, а в изобутане, где разветвлённая цепь атомов, центральный атом связан с тремя атомами углерода. Поэтому бутан и изобутан являются изомерами. Кроме того, что у этих веществ различное строение, они ещё имеют и различные свойства.

Различают изомерию структурную и пространственную. Одним из видов структурной изомерии является изомерия углеродного скелета. Так, у пентана есть 3 изомера. Это нормальный пентан, который имеет неразветвлённую цепь атомов углерода, 2-метилбутан, или изопентан, а также 2,2-диметилпропан, или неопентан.

Если посмотреть гомологический ряд алканов, то можно увидеть, что первые четыре члена этого ряда являются газами и имеют температуру кипения ниже комнатной. Алканы с С5 – С15 – жидкости, а алканы, которые имеют 16 и более атомов углерода – твёрдые вещества. С увеличение относительной молекулярной массы температуры плавления и кипения увеличиваются. Алканы практически не растворимы в воде.
Таким образом, общая формула алканов CnH2n+2. Длина С – С связи равна 0,154 нм. Для метана и его гомологов характерно тетраэдрическое строение. Основу названия алканов определяет самая длинная цепь атомов углерода, начиная с того конца, где ближе находится заместитель. Для алканов характерна изомерия углеродного скелета.
ГРУППА 301 ХИМИЯ 9,10
ТЕМА: Практическая работа №2
Получение, собирание и распознавание газов. Решение экспериментальных задач. (ПОСМОТРИТЕ ПРЕЗЕНТАЦИЮ И ОФОРМИТЕ РАБОТУ, ЕЩЕ ИМЕЮТСЯ МАТЕРИАЛЫ ПО ЭТОЙ РАБОТЕ ВО ВКЛАДКЕ "ЛАБОРАТОРНЫЕ РАБОТЫ"





Комментариев нет:
Отправить комментарий