ЧЕТВЕРГ 21.10.21г. 308, 401, 406
моя почта : rimma.lu@gmail.com
ВНИМАНИЕ!!! ОЛИМПИАДА ПО БИОЛОГИИ И ХИМИИ!!! ЗАДАНИЯ НА ВКЛАДКЕ НАШЕГО САЙТА http://kka.zorinsk.net/index.php/obuchayushchimsya/olimpiadnye-zadaniya
ГРУППА 308 химия, 17,18
ТЕМА:Практическая работа№4. Решение экспериментальных задач на распознавание органических веществ.
Тема урока: Практическая работа№4. Решение экспериментальных задач на распознавание органических веществ.
Цель урока: закрепить и применить знания курса химии в области химических свойств органических веществ;
Задачи урока:
Образовательная: закрепить знания по теме, уметь распознавать органические вещества, вспомнить качественные реакции на органические вещества.
Развивающая: продолжить формирование у учащихся самостоятельности, творческого поиска, основой которого является химический эксперимент.
Воспитательная: воспитывать у учащихся культуру поведения на уроке, культуру общения.
Планируемые результаты
Личностные:
- Формирование ответственного отношения к учению, готовности и способности к саморазвитию и самообразованию;
- Формирование убежденности в закономерной связи и познаваемости явлений природы;
- Формирование представления о системообразующей роли химии для развития других наук.
Метапредметные:
- Умение устанавливать причинно- следственные связи и обобщения на различном предметном материале.
- Умение планировать и контролировать свои действия.
Предметные:
· Приобретение опыта применения естественнонаучного метода познания, проведения опытов и простых экспериментальных исследований;
· Применять знания для объяснения принципов действия важнейших химических веществ и биологических процессов.
Оборудование: презентация.
Ход работы
1.Организационный этап урока.
Организация начала урока, проверка отсутствующих и готовность учащихся к уроку.
2. Мотивация учебной деятельности.
«Просто знать – ещё не всё, знания нужно уметь использовать»
4. Выполнение практической работы.
1. В трех пробирках даны следующие вещества: а) гексан; б) бензол; в) раствор уксусной кислоты. Определите каждое из веществ.
Раствор уксусной кислоты можно найти с помощью лакмусовой бумажки, она окрасится в красный цвет, или с помощью карбоната натрия, будет наблюдаться выделение газа: 2CH3COOH + Na2CO3 ⟶ 2CH3COONa + CO2↑ + H2O Бензол на воздухе горит ярким коптящим пламенем. Гексан на воздухе горит ярким пламенем, при этом копоти практически не образуется.
2. Выданы четыре пробирки: а) с глицерином; б) с этанолом; в) с раствором фенолята натрия; г) с формалином. Определите, в какой пробирке находится каждое из веществ.
Раствор фенолята натрия можно обнаружить с помощью индикатора, он покажет щелочную среду, т. к. фенолят натрия повергается гидролизу по аниону:
Раствор глицерина можно обнаружить с помощью свежеприготовленного гидроксида меди (II), при его нагревании с раствором глицерина в щелочной среде будет наблюдаться растворение осадка и окрашивание раствора в синий цвет:
Формалин можно обнаружить с помощью свежеприготовленного гидроксида меди (II), при его нагревании с формалином в щелочной среде будет наблюдаться изменение цвета гидроксида меди (II), в начале появляется жёлтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I):
Этанол можно определить с помощью накалённой медной спирали, покрытой чёрным оксидом меди (II), если её опустить в этанол, то спираль становится блестящей:
3. В трех пробирках даны следующие карбоновые кислоты: а) муравьиная; б) уксусная; в) олеиновая. Как различить эти вещества?
Муравьиную кислоту можно определить с помощью аммиачного раствора оксида серебра, при нагревании протекает реакция серебряного зеркала: HCOOH+Ag2O
аммиачный р-р−→−tH2O+CO2+2Ag↓
Распознать олеиновую кислоту можно с помощью бромной воды, она обесцветится, т. к. олеиновая кислота содержит двойную связь: C17H33COOH + Br2 ⟶ C17H33Br2COOH Оставшаяся кислота является уксусной кислотой, она обладает специфическим запахом.
4. Налейте в пробирку 2 мл этанола, прилейте к нему 2 мл разбавленного раствора перманганата калия и добавьте несколько капель серной кислоты. Нагрейте смесь. Почему изменилась окраска раствора?
Перманганат калия окисляет этанол до этаналя, поэтому происходит обесцвечивание раствора:
5C2H5OH + 2KMnO4 + 3H2SO4 ⟶ 5CH3CHO + K2SO4 + 2MnSO4 + 8H2O
ГРУППА 401 биология 10,11
Ядро
Ядро – важнейшая часть эукариотической клетки. Оно состоит из ядерной оболочки, кариоплазмы, ядрышек, хроматина.
1. Ядерная оболочка по строению аналогична клеточной мембране, содержит поры. Ядерная оболочка защищает генетический аппарат от воздействия веществ цитоплазмы. Осуществляет контроль за транспортом веществ.
2. Кариоплазма представляет собой коллоидный раствор, содержащий белки, углеводы, соли, другие органические и неорганические вещества. В кариоплазме содержатся все нуклеиновые кислоты: практически весь запас ДНК, информационные, транспортные и рибосомальные РНК.
3. Ядрышко – сферическое образование, содержит различные белки, нуклеопротеиды, липопротеиды, фосфопротеиды. Функция ядрышек – синтез зародышей рибосом.
4. Хроматин (хромосомы). В стационарном состоянии (время между делениями) ДНК равномерно распределены в кариоплазме в виде хроматина. При делении хроматин преобразуется в хромосомы.
Функции ядра: в ядре сосредоточена информация о наследственных признаках организма (информационная функция); хромосомы передают признаки организма от родителей к потомкам (функция наследования); ядро согласует и регулирует процессы в клетке (функция регуляции).
ТЕМА: Обмен веществ.
ПРОЧИТАЙТЕ, РАССМОТРИТЕ РИСУНКИ, СОЗДАЙТЕ КРАТКИЙ КОНСПЕКТ,МОЖНО ЧЕРТИТЬ СХЕМЫ,ГДЕ ЭТО НАДО.
Обязательным условием существования любого организма является постоянный приток питательных веществ и постоянное выделение конечных продуктов химических реакций, происходящих в клетках. Клетка постоянно находится в движении – цитоплазма перемещается, увлекая за собой органоиды и включения, активно работают рибосомы и митохондрии, совершается множество химических превращений. Все живые организмы, существующие на Земле, представляют собой открытые системы, характеризующиеся способностью активно обмениваться с окружающей средой веществами и энергией. Из окружающей среды в клетку поступают различные вещества, а из клетки в окружающую среду удаляются ненужные продукты обмена – происходит обмен веществ, или метаболизм (Рис. 1).

Рис. 1. Обмен веществ клетки с окружающей средой (Источник)
Питательные вещества используются организмами в качестве источника атомов химических элементов (прежде всего атомов углерода), из которых строятся либо обновляются все структуры. В организм, кроме питательных веществ, поступают также вода, кислород, минеральные соли.
Поступившие в клетки органические вещества (или синтезированные в ходе фотосинтеза) расщепляются на строительные блоки – мономеры и направляются во все клетки организма (Рис. 2). Часть молекул этих веществ расходуется на синтез специфических органических веществ, присущих данному организму. В клетках синтезируются белки, липиды, углеводы, нуклеиновые кислоты и другие вещества, которые выполняют различные функции (строительную, каталитическую, регуляторную, защитную и так далее).
Другая часть низкомолекулярных органических соединений, поступивших в клетки, идет на образование АТФ, в молекулах которой заключена энергия, предназначенная непосредственно для выполнения работы.

Рис. 2. Распределение органических веществ
Энергия необходима для синтеза всех специфических веществ организма, поддержания его высокоупорядоченной организации, активного транспорта веществ внутри клеток, из одних клеток в другие, из одной части организма в другую, для передачи нервных импульсов, передвижения организмов, поддержания постоянной температуры тела (у птиц и млекопитающих) и для других целей.
Обмен веществ (метаболизм) – совокупность биохимических реакций, протекающих в клетке и обеспечивающих процессы ее жизнедеятельности.
В ходе превращения веществ в клетках образуются конечные продукты обмена, которые могут быть токсичными для организма и выводятся из него (например, аммиак). Таким образом, все живые организмы постоянно потребляют из окружающей среды определенные вещества, преобразуют их и выделяют в среду конечные продукты.
В зависимости от общей направленности процессов выделяют катаболизм и анаболизм.
Анаболизм (ассимиляция) – совокупность химических процессов, направленных на образование и обновление структурных частей клеток, этот процесс имеет второе название – пластический обмен.
Фотосинтез: 6Н2О + 6СО2 → С6Н12О6 + 6СО2 ↑
Сюда можно отнести, например, фиксацию азота и биосинтез белка, синтез углеводов из углекислого газа и воды в ходе фотосинтеза, синтез полисахаридов, липидов, нуклеотидов, ДНК, РНК и других веществ. Анаболизм является созидательным этапом обмена веществ, он всегда осуществляется с потреблением энергии и с участием ферментов.
Катаболизм (диссимиляция) – совокупность реакций, в которых происходит распад крупных органических молекул до простых соединений с одновременным высвобождением энергии.
Катаболизм обеспечивает энергией все процессы, протекающие в клетке, и имеет второе название – энергетический обмен.
Дыхание: С6Н12О6 + 6СО2 → 6Н2О + 6СО2 + АТФ
При разрыве химических связей молекул органические соединения энергии высвобождаются и запасаются главным образом в виде молекул аденозинтрифосфорной кислоты – АТФ, универсального источника энергии у всех живых организмов (Рис. 3).

Рис. 3. Строение молекулы АТФ
По своей химической природе АТФ является мононуклеотидом и состоит из азотистого основания аденина, углевода рибозы и трех остатков фосфорной кислоты, соединенных между собой макроэргическими связями. Выделение энергии в клетке происходит при отделении одного из фосфорных остатков от молекулы АТФ, разрыв этой связи высвобождает 7,3 килокалории, тогда как при разрыве химических связей других соединений энергии выделяется в три-четыре раза меньше. При этом образуется молекула аденозиндифосфата – АДФ, с двумя фосфорными остатками. Она легко может восстановиться до АТФ, присоединив один остаток фосфорной кислоты или отдать еще один фосфорный остаток и превратиться в аденозинмонофосфат – АМФ (Рис. 4).

Рис. 4. Выработка энергии в клетке
Переход АТФ в АДФ и обратно – это основной механизм выработки энергии в клетке. Отщепление от АТФ и АДФ фосфорного остатка приводит к выделению энергии, а присоединение к АМФ и АДФ фосфорного остатка приводит к накоплению энергии.
ТЕМА: Зависимость растворимости газов, жидкостей и твердых веществ от различных факторов. Растворимость зависит от природы растворяемого вещества и растворителя, температуры, давления и влияния посторонних веществ. Природа веществ, образующих раствор. Этот фактор хорошо иллюстрирует старое правило: подобное растворяется в подобном. Под подобием подразумевают природу химической связи в веществах, образующих раствор. Действительно, две неполярные жидкости будут смешиваться друг с другом неограниченно, а неполярная и полярная жидкости будут практически нерастворимы друг в друге. Вещества, состоящие из неполярных молекул, лучше растворяются в неполярных растворителях, например, сера хорошо растворяется в сероуглероде и практически не растворяется в воде. Кислород в воде растворяется в 10 раз хуже, чем в бензоле. Вещества с ионным и ковалентным полярным характером связи, как правило, хорошо растворяются в сильно полярных растворителях. Однако ионные кристаллические структуры гораздо прочнее, чем молекулярные, поэтому, когда энергия кристаллической решетки велика, а энергия сольватации низка, растворимость таких соединений в воде мала (BaSO4, CuS, CaF2 и т.д.). Максимальную энергию кристаллической решетки имеют полимерные соединений с ковалентной связью (алмаз, диоксид кремния и т.д.), поэтому растворимость таких веществ ничтожно мала в любых растворителях. Температура. Согласно принципу Ле Шателье, на зависимость растворимости от температуры влияет значение теплового эффект растворения данного вещества в данном растворителе. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость будет уменьшаться (например, Ca(OH)2 в воде) и наоборот. Для большинства солей растворимость при нагревании увеличивается. Практически все газы растворяются с выделением тепла, поэтому растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением температуры - увеличивается. Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества сильно изменяют свою растворимость в зависимости от температуры, другие - не очень сильно (табл. 2). Таблица 2. Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды
Если полученные экспериментальным путем значения растворимости при различных температурах нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 3). Эти кривые имеют большое практическое значение. Используя эти кривые, можно рассчитать, сколько вещества, например KNO3, выпадет в осадок при охлаждении до 20оС насыщенного раствора, приготовленного при температуре 80оС. На этом основаны процессы, которые позволяют очищать некоторые вещества. Дело в том, что при охлаждении ненасыщенного раствора образуется насыщенный раствор, но насыщенный по основному веществу, которого больше всего, а не по примесям. Поэтому при охлаждении в осадок выпадает только чистое вещество, а примеси (вместе с частью вещества) остаются в растворе. Чистые кристаллы потом отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
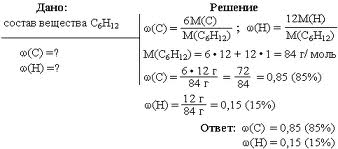
Рис. 3. Кривые растворимости твердых (а) и газообразных (б) веществ. Давление. По принципу Ле Шателье увеличение давления смещает равновесие в сторону уменьшения объема системы. При растворении твердых веществ в жидкости объем изменяется мало, поэтому давление не будет существенным образом влиять на растворимость солей. Также влияние давления практически не будет проявляться и для смеси двух жидкостей. Растворимость газов сильно зависит от давления, так как в этом случае происходит значительное изменение объема системы. С увеличением давления растворимость газов увеличивается. Для смеси газов растворимость каждого из них определяется законом Генри: Растворимость летучего вещества при постоянной температуре прямо пропорциональна его парциальному давлению над раствором. Закон справедлив для разбавленных растворов, невысоких давлений и при отсутствии химического взаимодействия с растворителем. ТЕМА: Массовая доля растворенного вещества. Массовая доля.Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2). Рис.2. Массовая доля компонентов смеси. Посмотрев видео вы вникнете в понятие массовой доли и научитесь ее вычислять. Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия». Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3). Рис.3. Массовая доля жира в молоке. Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.: m(раствора) = m(растворителя) + m(растворенного вещества). Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя. Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач Рис.4. Задача на нахождение массовой доли. |







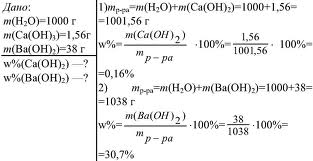
Комментариев нет:
Отправить комментарий