13.11.21г. Суббота (за пятницу) 301,408, 303
ГРУППА 301 ХИМИЯ 23,24
Тема: Химические свойства алканов.
Химические свойства алканов (метана, этана): горение, замещение, разложение, дегидрирование. Применение алканов на основе свойств. Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: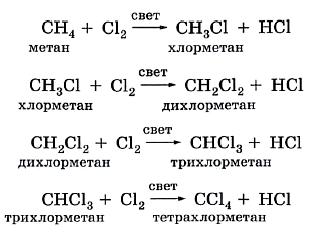
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речьПОЗЖЕ .
Тема: Применение алканов на основе свойств.
Области применения алканов связаны с их физико-химическими свойствами:
Таблица «Предельные углеводороды
(алканы, парафины)»

ГРУППА 408 ХИМИЯ 15
ТЕМА: ЦИКЛОАЛКАНЫ
ЗАДАНИЕ: ПОСМОТРИТЕ И ЗАКОНСПЕКТИРУЙТЕ ИНФОРМАЦИЮ.ВЫУЧИТЕ НАЗВАНИЯ ЦИКЛОАЛКАНОВ, ЗАПОМНИТЕ СВОЙСТВА.Гомологический ряд алкинов
Как правило, любое научное открытие не только имеет теоретическую ценность, но и находит практическое применение. В химической науке есть немало примеров того, как практическое использование свойств вновь открытых веществ приводило к созданию новых материалов или технологий.
В 1836 г. английский химик Эдмунд Дэви предложил для газовых фонарей, освещавших улицы в те времена, особый «светильный газ», который горел красноватым коптящим пламенем. Четверть века спустя французский химик М. Бертло определил формулу светильного газа — С2Н2. Вскоре это вещество получило своё общепринятое (тривиальное, т. е. исторически сложившееся) название — ацетилен. В конце XIX в. французский химик Анри Ле Шателье сделал важное открытие: при горении ацетилена в чистом кислороде
2С2Н2 + 5O2 → 4С02 + 2Н2O + Q
температура пламени достигала 3100 °С, что в 2 раза выше температуры плавления железа! Это свойство кислородно-ацетиленового пламени используют и сейчас при газовой резке и сварке металлов.
В XX в. было установлено строение молекулы ацетилена. Как оказалось, в ней два атома углерода связаны тройной углерод-углеродной связью:
H—C≡C—H
Ацетилен — первый представитель гомологического ряда ацетиленовых углеводородов.
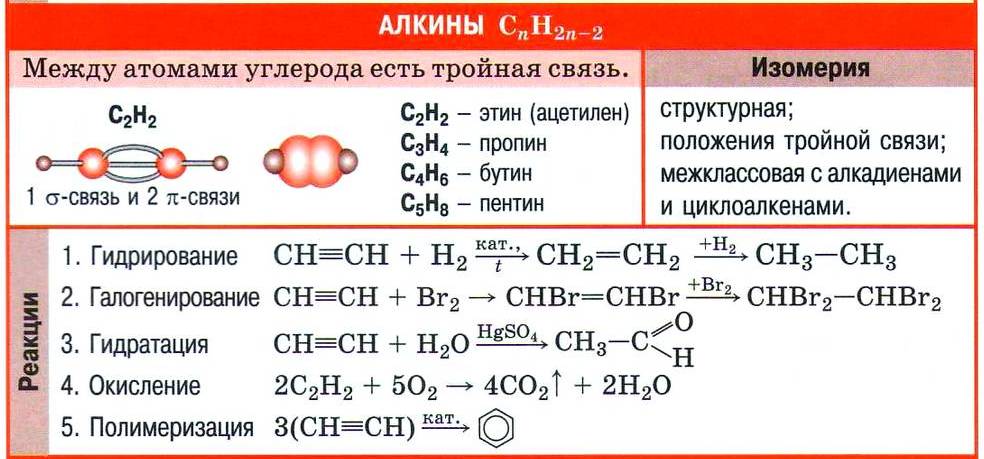
| Углеводороды с общей формулой СnН2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С, называют ацетиленовыми углеводородами или алкинами. |
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура и изомерия алкинов
Принадлежность углеводорода к алкинам обозначают суффиксом -ин, который указывает на тройную углерод-углеродную связь в молекуле. За основу названия алкина берут корень названия соответствующего алкана. Так, ацетилен в соответствии с номенклатурой ИЮПАК называют этином.
Формулы некоторых алкинов и их названия приведены в таблице.
Для алкинов, как и для алкенов, характерна изомерия положения кратной (тройной) связи. Например, изомерны бутин-1 и бутин-2.
Кроме этого, следует учесть, что гомологический ряд алкинов имеет такую же общую формулу, как и ещё один гомологический ряд уже знакомых вам углеводородов (алкадиенов): CnH2n–2. Такой вид структурной изомерии называют межклассовой изомерией.
Способы получения ацетилена
Рассмотрим способы получения важнейшего представителя класса алкинов — ацетилена.
Карбидный способ основан на взаимодействии карбида кальция с водой: ![]()
В промышленности карбид кальция получают сплавлением оксида кальция (негашёной извести) с коксом (углеродом): ![]()
Оксид кальция получают обжигом известняка по реакции: ![]()
В промышленном масштабе ацетилен получают метановым методом — пропусканием газообразного метана в специальных реакторах через зону с высокой (1500 °С) температурой: ![]()
Химические свойства алкинов
Тройную связь в молекулах алкинов обнаруживают с помощью двух качественных реакций — обесцвечивания бромной воды и раствора перманганата калия.
Непредельный характер алкинов обусловливает и наиболее характерные реакции веществ этого класса — реакции присоединения, которые протекают в две стадии. Например, реакция бромирования ацетилена:
Реакцию присоединения галогеноводородов к алкинам мы рассмотрим на примере важной в практическом отношении реакции хлороводорода с ацетиленом: 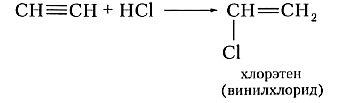
Хлорэтен называют также винилхлоридом, потому что одновалентный радикал этилена СН2=СН— носит название винил. Хлорэтен — исходное вещество для получения ценного полимера поливинилхлорида. Уравнение реакции полимеризации хлорэтена выглядит так:

Как и этилен, ацетилен вступает в реакцию гидратации, т. е. присоединяет воду. Однако отличие тройной углерод-углеродной связи от двойной отражается на строении продукта реакции гидратации. Схематично присоединение воды к ацетилену можно изобразить так: 
или 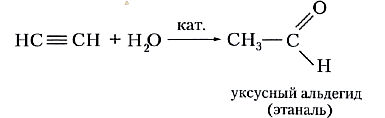
Реакция гидратации ацетилена названа в честь русского учёного-химика Михаила Григорьевича Кучерова, предложившего для проведения этого процесса использовать в качестве катализатора соли ртути(II). Продукт реакции Кучерова — органическое вещество уксусный альдегид. До середины XX в. реакция Кучерова лежала в основе промышленного получения уксусного альдегида, но в настоящее время её не используют из-за токсичности солей ртути. Получение уксусного альдегида по реакции Кучерова было вытеснено так называемым Вакер-процессом — получением ацетальдегида прямым окислением этилена в присутствии катализатора — хлорида палладия(II).
Комментариев нет:
Отправить комментарий