ПОНЕДЕЛЬНИК, 22.11.21г. 306, 301, 208,308
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 301 ХИМИЯ 27,28| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 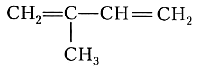
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 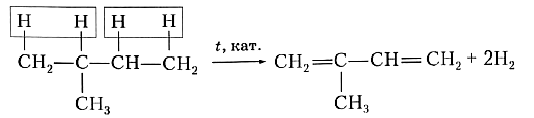
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 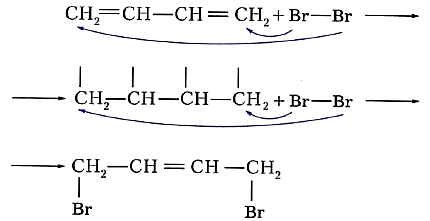
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 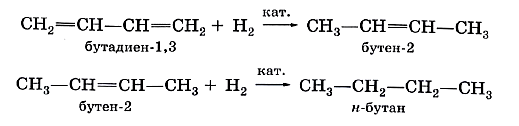
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 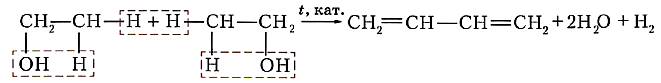
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
ГРУППА 208 ХИМИЯ 10, 11
Не забываем готовиться к экзамену!!!
ТЕМА: Химическое равновесие. Условия смещения химического равновесия. Принцип Ле Шателье.
Внимательно слушаем и составляем конспект, по которому можем пересказать тему.
ГРУППА 308 ХИМИЯ 29,30
ТЕМА: Применение целлюлозы.
Волокна льна и хлопка, в основном состоящие из целлюлозы, используют для изготовления нитей и тканей.
Сложные эфиры целлюлозы с уксусной кислотой используют для получения искусственного ацетатного волокна (ацетатного шёлка).
Целлюлоза, выделенная из древесины, используется для изготовления бумаги. Для получения бумаги измельченную древесину варят в присутствии кислотных или щелочных реагентов. Получаемую после варки техническую целлюлозу очищают и отбеливают. До начала XIX века листы бумаги изготавливали вручную путём вычерпывания бумажной массы формой с сетчатым дном и сушкой отдельных листов, но в конце XVIII — начале XIX века появились бумагоделательные машины, которые формировали бумагу на непрерывно движущейся конвейерной сетке и наматывали её в огромные рулоны.
Бумага из чистой целлюлозы слишком пористая, чернила и краски на ней расплываются. Таким материалом является фильтровальная бумага, имеющаяся в кабинете химии. При получении высококачественной бумаги для письма и копировальной техники в бумажную массу вводят специальные добавки (мел и другие наполнители, отбеливатели, клей). Поверхность бумаги для копировальной техники подвергают специальной обработке во избежание накапливания на ней статического электричества. Поэтому неудивительно, что некоторые сорта бумаги стоят довольно дорого.
В организме человека нет ферментов, способных расщеплять связи между остатками β-глюкозы. Поэтому, в отличие от крахмала, целлюлоза не может быть питательным веществом для человека. Однако жвачные животные содержат в желудке микроорганизмы, способные расщеплять молекулы целлюлозы, поэтому для жвачных животных целлюлоза является источником энергии.
Целлюлоза является природным полисахаридом, она содержится в клеточных стенках растений. Молекулярная формула целлюлозы — (C6H10O5)n. Макромолекулы целлюлозы состоят из остатков β-глюкозы, связанных между собой кислородными мостиками. В отличие от крахмала, макромолекулы целлюлозы имеют неразветвлённое строение, поэтому могут располагаться параллельно друг другу и образовывать между собой множество водородных связей. Этим объясняется высокая прочность целлюлозы. В результате полного гидролиза целлюлозы образуется глюкоза. Целлюлоза образует сложные эфиры с уксусной и азотной кислотами. Целлюлозу используют для получения волокон, бумаги, бездымного пороха. |
ТЕМА: Практическая работа №5. Решение экспериментальных задач на получение и распознавание органических веществ.
На двойном листке
Подпишите титульный лист
Практическая работа №5
по химии
уч-ся группы ____
ГБОЦ СПО ЛНР "ККА"
ФИО
ЗАТЕМ ОТКРЫВАЕТЕ, ПИШЕТЕ ЧИСЛО
ПРАКТИЧЕСКАЯ РАБОТА №5
«Решение экспериментальных задач на получение и распознавание органических веществ».
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 ![]() СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11-----серн.к-та------------12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
(((
1. Распознавание уксусной кислоты (уксусная кислота – одна из самых древних кислот, которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты) СuSО4 + 2NаОН →Сu(ОН)2 ↓+ Nа2SО4
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → Сu(ОН)2 ↓ + Nа2SО4
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина (глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган. в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод (черное в-во) С12Н22О11---серн.к-та--12С+11Н2О
5. Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.)))_
ГРУППА 306 ХИМИЯ 29,30
ТЕМА: Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
ТЕМА:Применение ацетилена на основе свойств.
Алкины – непредельные углеводороды, молекулы которых помимо одинарных С-С- связей содержат одну тройную С≡С-связь.
Общая формула ряда – СnH2n-2
Особенности номенклатуры алкинов
Принадлежность углеводорода к классу алкенов отражают суффиксом –ин:
С2Н2 CH≡CH этин (ацетилен)
С3Н4 CH≡C-СН3 пропин
С4Н6 CH≡C-СН2-СН3 бутин-1
и т.д.
Правила названия соединений остаются такими же, как и для алкенов, лишь суффикс заменяется на –ин.

Изомерия алкинов
Структурная изомерия.
Изомерия строения углеродной цепи.
Изомерия положения тройной связи.
Межклассовая изомерия.
Приведите примеры изомеров каждого типа, назовите их!
Особенности строения молекул (на примере ацетилена)
В ацетилене углерод находится в состоянии sp-гибридизации (в гибридизации участвуют одна s и 1 p-орбиталь). У каждого атома углерода в молекуле этилена – 2 гибридные sp-орбитали и по две негибридные р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 180°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.
Схема образования σ-связей в молекуле ацетилена

Четыре негибридные р-орбитали атомов углерода перекрываются во взаимноперпендикулярных плоскостях, которые расположены перпендикулярно к плоскости σ-связей. Так образуются две π-связи.
С≡С = σ + 2 π
Схема образования π-связей в молекуле этилена

Строение молекулы ацетилена

Физические свойства
Ацетилен – газ, легче воздуха, малорастворим в воде, без запаха. С воздухом образует взрывоопасные смеси.
В ряду алкинов с увеличением молекулярной массы возрастает температура кипения.
Получение
Способы получения ацетилена:
Из карбида кальция. (Лабораторный способ)
СаС2 + 2Н2О → С2Н2 ↑ + Са(ОН)2
Получение карбида кальция (в промышленности):
СаО + 3С СаС2 + СО↑
оксид кальция кокс карбид кальция
СаСО3 CaO + CO2
карбонат кальция оксид кальция
Термическое разложение метана.
2СН4 С2Н2 + 3Н2↑
Способы получения гомологов ацетилена – углеводородов ряда алкинов:
Дегидрогалогенирование - отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода:
Реакция идет под действием спиртового раствора щелочей на галогенпроизводные.
СН3 - СВr2 - СН3 + 2КОН
→
СН3-С ≡ СН + 2КВr + 2Н2О,
2,2 – дибромпропан пропин
Химические свойства
Реакции присоединения
Взаимодействие с галогенами
Качественная реакция на наличие кратных связей – обесцвечивание бромной воды!
Реакции присоединения идут в две стадии.

С водородом – гидрирование

kt – Ni, Pt, Pd.
С галоенводородами
![]()
(1-хлорэтен) – винилхлорид
С водой - гидратация (реакция Кучерова).

ацетальдегид
С металлами.
Продукт реакций – ацетилениды – малорастворимые, неустойчивые, взрывоопасные вещества!
Образование серовато-белого осадка ацетиленида серебра или красно-коричневого осадка ацетиленида меди – качественная реакция на концевую тройную связь!

Реакции окисления.
Горение.
![]()
Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) – качественная реакция на кратные связи!
Продуктами реакции окисления могут быть разные вещества, если окисление полное – то, основные продукты реакции – углекислый газ и вода.
![]()
Реакции полимеризации.
Ацетилен может полимеризоваться в бензол и винилацетилен.
Полимеризация винилхлорида

Из поливинилхлорида (ПВХ) получают прочную пластмассу, искусственную кожу, клеенку, диэлектрики и др.
Применение ацетилена
Сырье в органическом синтезе (производство волокон, красителей, лаков, лекарств, ПВХ, хлорорпренового каучука, уксусной кислоты, растворителей и др.)
При резке и сварке металлов.
Комментариев нет:
Отправить комментарий