ЧЕТВЕРГ 23.12.21 Г. 208,401,406
ГРУППА 208 химия 22,23
Тема:Понятие о коррозии металлов. Способы защиты от коррозии.
Понятие о коррозии металлов. Способы защиты от коррозии
Посмотрите учебный фильм "Коррозия металлов, способы защиты от неё" и ответьте на вопросы:
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ 1. Коррозия (от латинского «corrodere» разъедать) – самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой. 2. Виды коррозии: химическая и электрохимическая I. Химическая – коррозия, обусловленная взаимодействием металлов с веществами, содержащимися в окружающей среде, при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе. К химической коррозии относятся: - газовая коррозия - коррозионное разрушение под воздействием газов при высоких температурах; - коррозия в жидкостях-неэлектролитах. Газовая - химическая коррозия, обусловленная взаимодействием металлов с газами. Основной окислитель – кислород воздуха. Процессы химической коррозии железа: 2Fe + O2 = 2FeO 4Fe + 3O2 = 2Fe2O3 3Fe + 3O2 = FeO·Fe2O3 (смешанный оксид железа (II, III) ) 4Fe + 3O2 + 6H2O = 4Fe(OH)3 (на воздухе в присутствии влаги) Fe(OH)3 t °C→ H2O + FeOOH (ржавчина) 3Fe + 4H2O(пар) = Fe3O4 + 4H2 2Fe + 3Cl2 = 2FeCl3 Химическая коррозия в жидкостях-неэлектролитах Жидкости-неэлектролиты - это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется. Если вдобавок увеличится температура, в жидкости окажется растворенный кислород - химическая коррозия усилится. Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму. Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий: - подход окислителя к поверхности металла; - хемосорбция реагента на поверхности; - реакция окислителя с металлом (образование оксидной пленки); - десорбция оксидов с металлом (может отсутствовать); - диффузия оксидов в неэлектролит (может отсутствовать). Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде. II. Электрохимическая – окислительно-восстановительное разрушение сплавов и металлов, содержащих примеси, с возникновением электрического тока в системе.
Пример: Электрохимическая коррозия железной детали с примесями меди во влажном воздухе. А: Fe0 - 2ē → Fe2+ (Окисление) К: O2 + 2H2O + 4ē → 4OH- (процесс восстановления) Итог: 2Fe + O2 + 2H2O = 2Fe(OH)2 (белая ржавчина) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (бурая ржавчина) Fe(OH)3 = FeOOH + H2O III. Защита от коррозии: 1). Металлические покрытия – анодное (покрытие более активным металлом Zn, Cr) – оцинкованное железо; катодное (покрытие менее активным металлом Ni, Sn, Ag, Au) – белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия. 2). Неметаллические покрытия – органические (лаки, краски, пластмассы, резина - гумирование, битум); неорганические (эмали). 3). Протекторная защита – присоединение пластины из более активного металла (Al, Zn, Mg) – защита морских судов. 4). Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении. 5). Добавление ингибиторов ( в зависимости от природы металла – NaNO2, Na3PO4, хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние. |
Обзор металлов главных подгрупп (А-групп) периодической системы химических элементов.
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие.
Химические свойства щелочных металлов
- Взаимодействие с неметаллами
2Na + Cl2→ 2NaCl
3Na + P Na3P
- Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
- Взаимодействие с водой
Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
- Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза расплава солей, чаще всего хлоридов.
Щелочноземельные металлы
Химические свойства
- Взаимодействие с неметаллами
Сa + S СaS
Сa + H2 СaH2
- Взаимодействие с кислородом
2Сa + O2 → 2CaO
- Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
- Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 3Ba + Al2O3
(ПРОДОЛЖЕНИЕ СМ. В ЭЛЕКТРОННОМ УЧЕБНИКЕ-ПАРАГРАФ 21
ГРУППА 401 биология 24,25
Законы Менделя кратко и понятно
 В 19 веке австрийский ботаник и биолог Грегор Иоганн Мендель проводил исследования посевного гороха. Он смог установить, как передаются признаки по наследству. Это исследование выявило три закономерности, которые получили название «Законы Менделя».
В 19 веке австрийский ботаник и биолог Грегор Иоганн Мендель проводил исследования посевного гороха. Он смог установить, как передаются признаки по наследству. Это исследование выявило три закономерности, которые получили название «Законы Менделя».
Открытие Менделя заложило основу генетики, науки изучающей вопросы наследования и изменения особенностей организмов. Она сгорала большую роль в развитии различных сфер человеческой деятельности.
Содержание:
Закон единообразия
Закон расщепления
Закон независимого наследования признаков
Заключение
ЗАКОН ЕДИНООБРАЗИЯ
Порядок проведения эксперимента
Этот закон был установлен в ходе первого этапа эксперимента. Были взяты два гороха с разными особенностями – разным цветом семян. Они были обозначены как родительские растения или «РР». Одни были желтые, другие зеленые. Для чистоты эксперимента проводилось искусственное опыление.
Результат
Результатом стало появление гороха первого поколения «F1». У таких растений семена всегда были желтыми. Это значит, что второе поколение представляло собой один определенный тип и имело признаки только одного из растений первого поколения (желтый цвет в данном случае). Такие признаки называются доминантными.
Таким образом у всего второго поколения проявилось единообразие, что и дало название закону.
ЗАКОН РАСЩЕПЛЕНИЯ
Порядок проведения эксперимента
Для следующего этапа исследования использовался только горох первого поколения. Мендель высадил его и оставил без вмешательства, чтобы горох мог самостоятельно опылиться. Это позволило появиться растениям второго поколения «F2».
Результат
Из-за самостоятельного опыления появились семена желтого и зелёного цвета. А поскольку жёлтый цвет является доминантным признаком, то соотношение семян желтого цвета к зеленому составило 3 к 1.
Разделение, а точнее расщепление родительского типа на два различных, дало название второму закону.
Данный опыт помог установить, что признак одного из родителей (зеленый цвет) не исчез полностью, а просто неактивен или подавлен. За него отвечал тот же ген, что и за желтый цвет, за который отвечала часть гена – доминантный аллель. Желтый цвет в себе содержала рецессивная аллель – «а», подавляемая доминантной «А».
Поэтому строение растений:
зеленый горох-родитель – две рецессивных аллели «аа»;
желтый горох-родитель – две доминантных аллели «АА»;
желтый горох первого поколения – одна доминантная и одна рецессивная аллели «Аа»;
желтый горох второго поколения – он может содержать следующие аллели: «АА», «Аа», «аА». В них цвет обуславливается наличием доминанта;
зеленый горох второго поколения – две рецессивных аллели «аа».
ТРЕТИЙ ЗАКОН НЕЗАВИСИМОГО НАСЛЕДОВАНИЯ ПРИЗНАКОВ
Порядок проведения эксперимента
Для третьего опыта Мендель использовал растения гороха с несколькими различающимися признаками: цвет семян и их гладкость. Один вид имел семена гладкие желтые, а второй – зеленые и ребристые.
В первом поколении растение приобрело следующие признаки: желтый цвет и гладкость семян.
Во втором поколении уже наблюдалось расщепление:
желтый цвет и гладкие семена;
желтый цвет и ребристые семена;
зеленый цвет и гладкие семена;
зеленый цвет и ребристые семена.
Получившийся результат говорит о том, что передача и наследование двух разных признаков не зависит друг от друга. А соответственно за гладкость отвечает другой ген, у которого своей набор аллелей. Гладкие семена обуславливаются сочетанием аллелей «BB», «Bb», «bB».
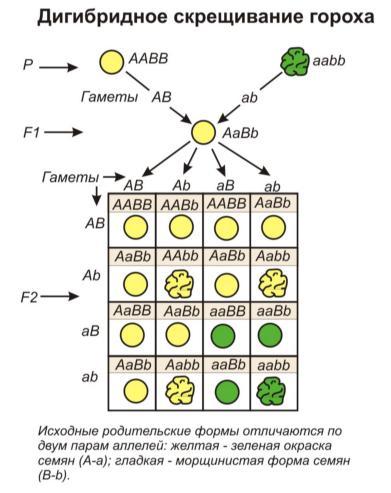
Таким образом строение растений:
зеленый горох-родитель с ребристыми семенами – «аа» и «bb»;
желтый горох-родитель с гладкими семенами – «АА» и «BB»;
желтый горох первого поколения с гладкими семенами – «Аа» и «Bb»;
желтый горох второго поколения с гладкими семенами – «АА», «Аа», «аА» в сочетании с «BB», «Bb», «bB».
желтый горох второго поколения с ребристыми семенами – «АА», «Аа», «аА» и «bb»
зеленый горох второго поколения с гладкими семенами – «аа» в сочетании с «BB», «Bb», «bB»;
зеленый горох второго поколения с ребристыми семенами «аа» и «bb».
Таким образом соотношение цветов и гладкости: 9-3-3-1.
ЗАКЛЮЧЕНИЕ
В ходе экспериментов Мендель смог установить, что любой ген может содержать рецессивную и(или) доминантную части. Она подавляет рецессивную. Обе эти части впоследствии были названы аллелями. При соединении растений с разными генами, их аллели будут передаваться независимо друг от друга, что начнет проявляться во втором поколении. Если в первом поколении растение приобретает только доминантные признаки, то во втором начнут проявляться и рецессивные. На этом и основываются три закона Менделя и это позволяет ученым-генетикам предугадывать поведение организма при размножении.
Материал взят с сайта https://nauka.club
Второй закон Менделя (закон расщепления): При скрещивание гетерозиготных гибридов первого поколения происходит расщепление признаков в соотношении 3:1.
Третий закон Менделя (закон независимого наследования признаков): При дигибридном скрещивании расщепление по каждой паре признаков идет независимо от других признаков.
СМОТРИМ ВИДЕО, КОНСПЕКТИРУЕМ, УЧИМ.
1. Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
- изомерия положения заместителей в бензольном кольце
- изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей
4. Строение молекулы
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
3. Красителей
4. Поверхностно-активных веществ
5. Антиоксидантов
6. Антисептиков
7. Взрывчатых веществ
8-
9. Химические свойства фенола (карболовой кислоты)
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
- С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
фенолят натрия
- Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол |
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
II. Свойства бензольного кольца
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с альдегидами. Например:
2). Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор
Соли - это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+, гидроксилированных групп Ме(ОН)nm+) и одного (нескольких) кислотных остатков. Общая формула солей МеnАm, где А - кислотный остаток. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица - Классификация солей по составу
| СОЛИ | |||||
Средние (нормальные) - продукт полного замещения атомов водорода в кислоте на металл AlCl3 | Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 | Основные (гидроксосоли) -продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl | Двойные - содержат два разных металла и один кислотный остаток КNaSO4 | Смешанные - содержат один металл и несколько кислотных остатков CaClBr | Комплексные [Cu(NH3)4]SO4 |
Физические свойства. Соли - это кристаллические вещества разных цветов и разной растворимости в воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+ + Cl –+ Br–.
КHSO4 К+ + НSO4– HSO4–
H+ + SO42–.
FeOHClFeOH+ + Cl– FeOH+
Fe2+ + OH–.
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+
Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O
AlOH2+ + H+
3) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 СаO + СО2.
Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32– ® CO2 + H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 Cu2+ + 2OH– ® Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
2Na + Cl2 ® 2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3
ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O + 2HNO3 ® 2NaNO3 + H2O ZnO + H2SO4 ® ZnSO4 + H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH– + ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2 + H2SO4 ® CaSO4¯ + 2H2O Zn(OH)2 + H2SO4 ® ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH+4+ SO2-4;
Na3PO 4 -> 3 Na + + PO 3- 4
Кислые же и основные соли диссоциируют ступенчато:
Диссоциация кислых солей | Диссоциация основных солей |
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. KHSO4 -> K + + HSO -4 HSO -4 ↔ H + + SO 2-4 | У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg( OH )Cl -> Mg( OH )++ Cl - Mg ( OH )+↔ Mg2+ + OH |
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Дайте названия следующим солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
№2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
№3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.










Комментариев нет:
Отправить комментарий