ПЯТНИЦА, 21.01.22г. 401, 208, 301 ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:
- соблюдать отведенное время;
- разборчиво и правильно выполнить работу
Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 ХИМИЯ 28, 29
ТЕМА: Массовая доля растворенного вещества.
Массовая доля.
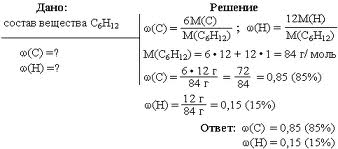
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).
Рис.2. Массовая доля компонентов смеси.
Посмотрев видео
вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).
Рис.3. Массовая доля жира в молоке.
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач
Рис.4. Задача на нахождение массовой доли.
ТЕМА:Электролитическая диссоциация. Электролиты и неэлектролиты.
СМОТРИМ, СЛУШАЕМ, КОНСПЕКТИРУЕМ.
ГРУППА 208 ХИМИЯ 33, 34, 35
ВНИМАНИЕ! Экзамен в МАРТЕ!
См. вкладку "Экзамен 208"и "Решаем задачи"и ещё
ТЕМА: Водородные соединения неметаллов. . Оксиды неметаллов. Кислородсодержащие кислоты.
Весь материал изложен на сайте РЭШ, проработайте полностью материал, просмотрите видео ,запишите главное кратко и выполните задание ниже:
Закончите уравнения химических реакций, дайте название веществам:
а) P + O2 →
б) Al + O2 →
в) H2SO4 + Fe2O3 →
г) BaO + HCl →
д) C2H4 + O2 →
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.((вопросы с ответами, проработайте!)
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
Ответ: 4, т.к. оксид серы (VI) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и оксидом кальция
2) оксидом кальция и оксидом серы (IV)
3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV)
Ответ: 1, т.к. оксид углерода (IV) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
3. Оксид серы (IV) взаимодействует с
1) СО2 2) Н2О 3) Na2SO4 4) НС1
Ответ:,2. т.к. оксид серы (IV) – кислотный, взаимодействует с основаниями, основными оксидами, водой.
4. Формулы кислотного, основного, амфотерного оксидов, соответственно
1)MnO2, CO2, Al2O3 2)CaO, SO2, BeO 3)Mn2O7, CaO, ZnO 4) MnO, CuO, CO2
Ответ: 3,т.к. Mn2O7 – кислотный, CaO - основный, ZnO - амфотерный
5. Способны взаимодействовать между собой
1) SiO2 и Н2О 2) СО2 и H2SO4 3) CO2 и Са(ОН)2 4) Na2O и Са(ОН)2
Ответ: 3, CO2 – кислотный оксид, Са(ОН)2 -основание, кислотные оксиды взаимодействуют с основаниями
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) NО
Ответ: 4,т.к. NО несолеобразующий
7. Реагирует с соляной кислотой, но не с водой, оксид
1) SiО2 2) N2O3 3) Na2О 4) Fе2Оз
Ответ: 4, т.к. Fе2Оз - амфотерный оксид с большим преобладанием основных свойств, взаимодействует с кислотами, не реагирует с водой (Fе(ОН)з – не растворим в воде).
ГРУППА 301 ХИМИЯ 45, 46
ТЕМА: Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал.
Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Крахмал по химическим свойствам является многоатомным спиртом, который может образовывать простые и сложные эфиры.
Характерная качественная реакция на крахмал - йодкрахмальная реакция. При помощи крахмала обнаруживается молекулярный йод I2.
Для проведения опыта приготавливается водный раствор крахмала – клейстер. В раствор капается капля йода, и клейстер в месте соприкосновения темно-коричневого йода приобретает насыщенный темно-синий цвет – это универсальная качественная реакция на йод.
Йод не взаимодействует с крахмалом с образованием валентных или ионных связей. Качественная реакция крахмала основывается на слабых межмолекулярных взаимодействиях.
.
Определение Амины – класс органических соединений, производные аммиака (NH3 СТРОЕНИЕ И КЛАССИФИКАЦИЯ АМИНОВПоскольку амины являются продуктами замещения водорода в аммиаке, то все они являются донорами электронной пары, принадлежащей атому азота, то есть проявляют свойства оснований (по Льюису).
Амины классифицируют: 1. По степени замещенности атомов водорода в молекуле аммиака на
Радикалы, входящие в молекулу амина могут быть одинаковыми или разными. 2. По типу радикала выделяют амины алифатического и ароматического ряда. Типичным представителем ряда ароматических аминов является анилин
Изомерия алифатических аминовДля алифатических аминов характерна следующая изомерия:
НОМЕНКЛАТУРА АМИНОВ 1. По систематической номенклатуре амины называют путем добавления суффикса "амин" к названию углеводорода. 2. По рациональной номенклатуре их рассматривают как алкил- или ариламины.
У ароматических аминов в основе названия также лежит слово амин, кроме того такие соединения имеют тривиальные названия:
3. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы - ФИЗИЧЕСКИЕ СВОЙСТВАПервые представители ряда аминов - метиламин, диметиламин и триметиламин – газы. Остальные низшие амины – жидкости. Обладают резким характерным удушливым запахом. Канцерогены. Высшие амины – твердые вещества, без запаха. Первые представители аминов хорошо растворимы в воде. Высшие амины в воде не растворяются. Это связано с тем, что связь N–H более полярна, чем связь С–H, но менее полярна, чем связь C–O, поэтому водородные связи между молекулами аминов выражены слабее, чем, например, в молекулах спиртов. Основные представителя ряда аминовАлкиламиныМетиламин По своим химическим свойствам метиламин является типичным первичным амином, то есть подобно аммиаку, образует четвертичные соли с кислотами и реагирует с водой, образуя донорно-акцепторную связь, при взаимодействии со сложными эфирами или ацилхлоридами дает амиды (подробнее см. тему: "Производные карбоновых кислот. Амиды. Ангидриды. Хлорангидриды") Триметиламин |


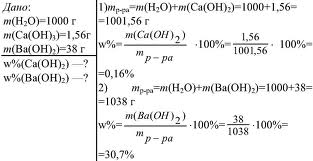









Комментариев нет:
Отправить комментарий