ЧЕТВЕРГ, 21.04.22 г. 403, 405
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время; - разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
Тема: |
ДИФФЕРЕНЦИРОВАННЫЙ ЗАЧЕТ ПО БИОЛОГИИ Вариант I 1. Приспособленность организмов к среде называют: а) адаптацией б) изменчивостью в) эволюцией г) наследственностью 2. Перечислите уровни организации жизни, начиная с низшего: а) клеточный б) организменный в) экосистемный г) молекулярный д) тканевыйе) органный ж) популяционно-видовой з) биосферный 3. Обмен веществами и энергией с окружающей средой начинается на уровне: а) атомов г) органов б) клеток д) тканей в) молекул 4. Элементарной единицей живого принято считать: а) молекулу г) ткань б) атом д) орган в) клетку 5. Термин биология первым стал использовать знаменитый … естествоиспытатель Жан-Батист Ламарк в … году. а) английский д) 1602 б) австрийский е) 1702 в) немецкий ж) 1802 г) французский з) 1902 6. Общая биология — наука, изучающая: а) все явления природы б) строение растений и животных в) функционирование растений и животных г) основные закономерности живой природы 7. Важнейшие органические соединения: а) липиды г) углеводы б) белки д) биоэлементы в) вода е) нуклеиновыекислоты 8. Найдите синоним слову жиры: а) белки в) липиды б) углеводы г) нуклеиновые кислоты 9. Какой элемент особенно необходим для щитовидной железы? а) F б) Cl в) J г) Br 10.Сколько процентов воды содержит головной мозг человека? а) 10 б) 20 в) 40 г) 85 11. В молекуле воды связи между атомами водорода и кислорода называются: а) водными д) ковалентными полярными б) водородными в) кислородными е) ковалентными неполярнымиг) ионными 12. Нервные импульсы распространяются по мембранам клеток, благо -даря катионам: а) кальция в) магния б) калия г) натрия 13. Сколько различных аминокислот входит в состав белков? а) 8 б) 20 в) 300 г) более 500 14. Инсулин — это ... (укажите все подходящие пункты). а) мономер д) гормон б) полимер е) фермент в) полипептид ж) белок г) радикал з) аминокислота 15. Для образования в организме молекулы белка необходимо: а) большое количество аминокислот б) определенные ферменты в) разнообразные пептидные связи г) большое количество времени 16. Что правильно? а) в клетках растений белков больше, чем углеводов б) в молоке содержится весь набор разных аминокислот в) цистеин — аминокислота, содержащая атом серы г) гидрофобные участки белка располагаются на поверхности 17. Кератин — это белок, из которого состоят перья, когти, копыта, рога. Такие белки являются: а) глобулярными в) нерастворимыми б) фибриллярными г) растворимыми 18. Какую функцию выполняют ферменты? а) защитную д) каталитическую б) регуляторную е) транспортную в) сигнальную ж) запасающую г) структурную з) двигательнуюи) энергетическую 19. Химическое название пищевого сахара: а) глюкоза г) мальтоза б) сахароза д) галактоза в) фруктоза е) лактоза 20. Мономеры нуклеиновых кислот: а) молекулы рибозы б) молекулы дезоксирибозыв) нуклеотиды г) азотистые основания д) остатки фосфорной кислоты е) молекулы пентозы ж) аденин, гуанин, цитозин, урацил з) аденин, гуанин, цитозин, тимин 21. Если в одной нити у молекулы ДНК есть последовательность ЦААГ, то в комплементарной нити ей соответствует: а) ГУУЦ в) ГТТЦ б) АГЦА г) УТТГ 22. Термин клетка впервые употребил: а) Гук г) Шванн б) Левенгук д) Шлейден в) Броун е) Вирхов 23. Органеллы делятся на две большие группы: а) ядерные и безъядерныеб) мембранные и немембранные в) прокариотическиеиэукариотическиег) клеточные и неклеточные 24. Пиноцитозом называют: а) поглощение бактерий лейкоцитами б) поглощение бактерий амебами в) проникновение капель жидкости через мембрану г) слияние в клетке маленьких пузырьков в один большой 25. Источником энергии для клетки может служить: а) кислород в) липидыб) углеводы г) белки 26. Расположите по порядку периоды жизни клетки: а) анафаза г) профазаб) метафаза д) интерфаза в) телофаза 27. Биологическая сущность мейоза заключается в том, что: а) появляется возможность кроссинговера хромосом б) возникает возможность появления уникальных организмов в) образуются гаметы с уменьшенным вдвое набором хромосом г) формируются два типа гамет — мужские и женские 28. Генетика изучает: а) законы изменчивости живых организмов б) материальные основы наследственности и изменчивости в) законы наследственности живых организмов г) законы появления новых признаков у животных и растений 29. Закончите смысловой ряд:хромосома — ген — … . а) триплет б) участок ДНК в) азотистое основание г) нуклеотид 30. Коровы дают молоко, поскольку только у них есть гены, которые: а) отвечают за его образование б) проявляются у женских особей в) способны к кроссинговеру г) контролируют его синтез в гомозиготном состоянии 
|

ТЕМА: КОНТРОЛЬНАЯ РАБОТА
(РЕШИТЕ ЗАДАЧИ, АНАЛОГИЧНЫЕ С РЕШЕНИЕМ СМОТРИТЕ ВО ВКЛАДКЕ "РЕШАЕМ ЗАДАЧИ")
1. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
2. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
3. Из образца горной породы массой 25 г, содержащей минерал аргентит
Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г; m = 25 г.
Найти: ω(Ag2S) =?
ГРУППА 405 ХИМИЯ 45,76
ТЕМА:Гидролиз солей. Гидролиз солей различного типа.
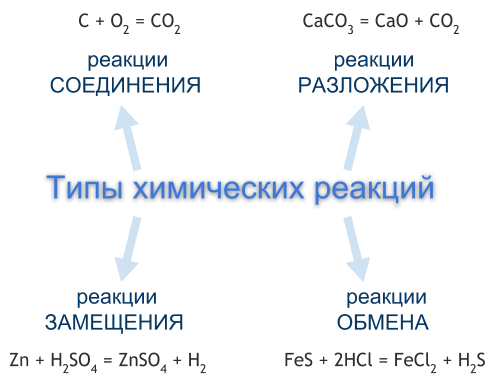
ТЕМА: Классификация химических реакций.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему. 1). Гидролиз не возможен Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. рН таких растворов = 7. Реакция среды остается нейтральной. 2). Гидролиз по катиону (в реакцию с водой вступает только катион) В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион: FeCl2 + HOH <=>Fe(OH)Cl + HCl В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион) Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы. K2SiO3 + НОH <=>KHSiO3 + KОН рН таких растворов > 7 (раствор приобретает щелочную реакцию). 4). Совместный гидролиз (в реакцию с водой вступает и катион и анион) Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑ Гидролиз - процесс обратимый. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота Алгоритм составления уравнений гидролиза солей
Практическое применение. На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной. В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает. Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III). На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. Видео - Эксперимент "Гидролиз солей" Видео - Эксперимент "Гидролиз солей, образованных сильным основанием и слабой кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и сильной кислотой" Видео - Эксперимент "Гидролиз солей, образованных слабым основанием и слабой кислотой" Видео - Эксперимент "Усиление гидролиза солей при нагревании" ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза: №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора: №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ: Известны следующие типы химических реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена. А) 4Al + 3O2 = 2Al2O3 -р.соединения Б) 2H2O= 2H2+ O2 -р. разложения В) ZnO + 2 HCl = ZnCl2 + H2O -р.обмена Г) СаСO3 = CaO + CO2 р.соединения Д)) Zn + 2HCl = ZnCl2 + H2 р.замещени Е) Na2O+ CO2=Nа2СO3 р. соединения ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ Пример 1. Введите формулу недостающего продукта реакции. CH3COOH + Ca(OH)2 → … + H2O. Решение Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска. |
ТЕМА: Реакции соединения, разложения, замещения, обмена. Реакция замещения меди железом в растворе медного купороса.
Типы химических реакций
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена. Однако существуют химические реакции, которые нельзя отнести ни к одному из перечисленных типов.
РЕАКЦИИ СОЕДИНЕНИЯ
Реакция соединения — это реакция, реагентами которой являются два или несколько простых или сложных веществ, а продуктом — одно сложное вещество.
Примеры реакций соединения
Образование оксидов из простых веществ:
C + O2 = CO2, 2Mg + O2 = 2MgO
Взаимодействие металла с неметаллом и получение соли:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие оксида с водой:
CaO + H2O = Ca(OH)2
РЕАКЦИИ РАЗЛОЖЕНИЯ
Реакция разложения — это реакция, реагентом которой является одно сложное вещество, а продуктом — два или несколько простых или сложных веществ. Чаще всего реакции разложения протекают при нагревании.
Примеры реакций разложения
Разложение мела при нагревании:
CaCO3 = CaO + CO2
Разложение воды под действием электрического тока:
2H2O = 2H2 + O2
Разложение оксида ртути при нагревании:
2HgO = 2Hg + O2
РЕАКЦИИ ЗАМЕЩЕНИЯ
Реакция замещения — это реакция, реагентами которой являются простое и сложное вещества, а продуктами — также простое и сложное вещества, но атомы одного из элементов в сложном веществе заменены на атомы простого реагента.
Примеры реакций замещения
Замещение водорода в кислотах:
Zn + H2SO4 = ZnSO4 + H2
Вытеснение металла из соли:
Fe + CuSO4 = FeSO4 + Cu
Образование щелочи:
2Na + 2H2O = 2NaOH + H2
РЕАКЦИИ ОБМЕНА
Реакция обмена — это реакция, реагентами и продуктами которой являются по два сложных вещества, в процессе реакции реагенты обмениваются между собой своими составными частями, в результате чего образуются другие сложные вещества.
Примеры реакций обмена
Взаимодействие соли с кислотой:
FeS + 2HCl = FeCl2 + H2S
Взаимодействие двух солей:
2K3PO4 + 3MgSO4 = Mg3(PO4)2 + 3K2SO4
|
Комментариев нет:
Отправить комментарий