СРЕДА , 11.05.22 г. 305,303, 408
ГРУППА 305 ХИМИЯ 23,24
ТЕМА: Применение этилена на основе свойств.
| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 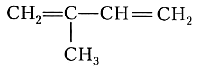
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 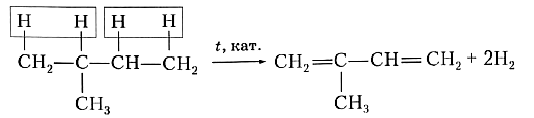
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 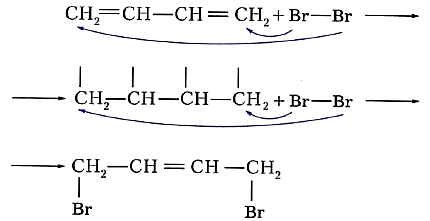
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 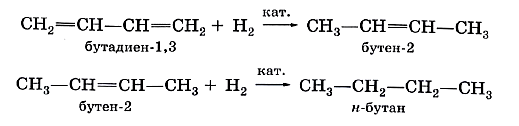
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 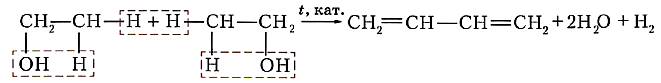
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
ГРУППА 408 ХИМИЯ 50
ТЕМА:Многоатомные спирты. Этиленгликоль.
 Содержание
Содержание
- Этиленгликоль
спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Наиболее широко известны два многоатомных спирта — этиленгликоль и глицерин. Рассмотрим свойства этих спиртов.
 Этиленгликоль
Этиленгликоль
 Физические свойства этиленгликоля
Физические свойства этиленгликоля
Этиленгликоль (тривиальное название), или этандиол (систематическое название). Химическая формула

Этиленгликоль
Этиленгликоль — двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество, температура вспышки его паров
 Химические свойства этиленгликоля
Химические свойства этиленгликоля
Этиленгликоль обладает всеми свойствами гликолей.
1. Взаимодействие со щелочными металлами
При взаимодействии этиленгликоля с щелочными металлами образуются соли — гликоляты. При этом этиленгликоль сначала образуется моноалкоголят, а затем — динатриевое производное:

2. Взаимодействие с органическими кислотами
В результате взаимодействия этиленгликоля с органическими кислотами образуются одно- и двухзамещенные сложные эфиры (аналогично глицерину):
3. Взаимодействие с галогеноводородами
Этиленгликоль взаимодействует с галогеноводородами, образуя этиленгалогенгидрины:
4. Дегидратация
При нагревании этиленгликоля в присутствии концентрированной серной кислоты возможно образование ацетальдегида:
В результате дегидратации возможно также образование циклического простого эфира — диоксана:

5. Качественная реакция на этиленгликоль
Качественной реакцией на многоатомные спирты является образование ярко-синего раствора при взаимодействии с гидроксидом меди(

 Применение этиленгликоля
Применение этиленгликоля
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
 Получение этиленгликоля
Получение этиленгликоля
В промышленности этиленгликоль получают путём гидратации оксида этилена при повышенном давлении и температуре в присутствии

Этиленгликоль может быть также получен окислением этилена перманганатом калия в нейтральной или слабощелочной среде:
Комментариев нет:
Отправить комментарий