ВТОРНИК, 10.05.22 г. 401,405, 305
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время; разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 БИОЛОГИЯ 41,42
ТЕМА: Многообразие органического мира. Класификация организмов.
ТЕМА: Происхождение человека.Ближайшие «родственники» человека среди животных.
ТЕМА 1: Многообразие органического мира. Классификация организмов.
МНОГООБРАЗИЕ ОРГАНИЧЕСКОГО МИРА
НЕОБХОДИМО ЗАПОМНИТЬ
ВАЖНО!
Всю жизнь великий ученый Карл Линней посвятил систематизации живой и неживой природы. Основной его труд — «Система природы», в котором он описал огромное для того времени число видов растений и животных. В первом издании этой книги было лишь 13 страниц, а в последнем, двенадцатом — 2335. Если бы мы сегодня попытались описать все известные нам виды растений, животных, грибов, микроорганизмов, уделив каждому виду по 10 строк, то описания заняли бы 10 тыс. таких книг, как «Система природы».

КАРЛ ЛИННЕЙ (1707–1778)
Шведский натуралист, врач. Основоположник принципов и методов систематики органического мира. Основатель и первый президент Шведской академии наук. Почетный член Санкт-Петербургской академии наук.
Карл Линней впервые ввел в науку систему двойных латинских названий живых организмов, так называемую бинарную номенклатуру, которая позволила установить порядок в описании новых видов. Введение латыни для научных наименований живых организмов существенно облегчило общение ученых разных стран. Каждый организм должен в соответствии с требованиями бинарной номенклатуры именоваться сначала родовым названием (пишется с прописной буквы), а затем видовым (пишется со строчной буквы).
В разных районах нашей страны одного и того же зверька – степного сурка называют по-разному: байбак, бабак, бабачок, тарбаган, свиц, свистун, суур, сугур, эксачок. Научное же латинское название этого вида – Marmota bobak (сурок-байбак) – является единственным, которым пользуются зоологи.
Искусственная и естественная системы. Если нам нужно установить порядок в книгохранилище, то мы можем исходить из самых разных принципов. Можем классифицировать книги, например, по цвету обложки или формату. Подобная классификация книг искусственна, так как она не отражает главного — содержания книг.
Система Линнея была во многом искусственной. В основу классификации он положил сходство организмов по некоторым наиболее легко отличимым признакам. Но эти сходные признаки не всегда означают их общее происхождение. Линнею еще не были известны очень многие научные факты, позволяющие оценить степень родства тех или иных организмов. Объединив растения по числу тычинок, по характеру опыления, Линней в ряде случаев создал совершенно искусственные группы. Так, в класс растений с пятью тычинками он объединил морковь, лен, лебеду, колокольчики, смородину и калину. Из-за различий в числе тычинок ближайшие родственники, например брусника и черника, попали в разные классы. Зато в другом классе (однодомных растений) встретились осока, береза, дуб, ряска, крапива и ель. Однако, несмотря на эти очевидные просчеты, искусственная система Линнея сыграла огромную роль в истории биологии, так как помогала ориентироваться в огромном многообразии живых существ. Когда К. Линней и его последователи группировали близкие виды в роды, роды – в семейства и т. д., они брали за основу внешнее сходство форм. Причины такого сходства оставались нераскрытыми.
Решение этого важнейшего вопроса принадлежит Ч. Дарвину, который показал, что причиной сходства может быть общность происхождения, т. е. родство. Со времен Дарвина систематика стала эволюционной наукой. Если теперь зоолог-систематик объединяет роды собак, лисиц и шакалов в единое семейство псовых, то он исходит не только из внешнего сходства форм, но и из общности их происхождения (родства). Общность происхождения доказывается изучением исторического развития и строения ДНК описываемых видов.
Для того чтобы построить систему той или иной группы, ученые используют совокупность наиболее существенных признаков: изучают ее историческое развитие по ископаемым остаткам, исследуют сложность анатомического строения современных видов, особенности размножения, сложность организации (неклеточные – клеточные, безъядерные – ядерные, одноклеточные – многоклеточные), сравнивают их эмбриональное развитие, особенности химического состава и физиологии, изучают тип запасающих веществ, современное и прошлое распространение на нашей планете. Это позволяет определить положение данного вида среди остальных и построить естественную систему, отражающую степень родства между группами организмов.
Система безъядерных организмов оставалась искусственной вплоть до второй половины XX столетия. Это объясняется тем, что в распоряжении ученых еще не было точных методов определения степени родства микроорганизмов. Применение современных методов молекулярной биологии позволило положить в основу систематики прокариот строение их геномов. Результаты оказались впечатляющими. Стало очевидным, что многие прокариоты, ранее объединявшиеся в те или иные систематические группы, совсем не родственны друг другу. Хорошо известная ранее группа экстре-мофильных (живущих в экстремальных условиях) прокариот оказалась настолько отличной от бактерий, что их пришлось выделить в отдельное царство – археи. Ранее включавшиеся в царство растений синезеленые водоросли оказались совсем не растениями, они составляют подцарство цианобактерий в царстве бактерий. Вот как выглядит упрощенная схема соподчинения систематических единиц, используемых для естественной классификации:
ИМПЕРИЯ (неклеточные и клеточные)
НАДЦАРСТВО (прокариоты и эукариоты)
ЦАРСТВО (растения, животные, грибы, бактерии, археи, вирусы)
ПОДЦАРСТВО (одноклеточные, многоклеточные)
ТИП (например, членистоногие или хордовые)
КЛАСС (например, насекомые)
ОТРЯД (например, бабочки)
СЕМЕЙСТВО (например, белянки)
РОД (например, белянка)
ВИД (например, капустная белянка)
Интерактивная схема «Доказательства эволюции»
Все организмы на молекулярном уровне имеют ДНК и РНК, осуществляющие кодирование и реализацию генетической информации.
Все живые организмы имеют клеточное строение. Клетки сходны по своему химическому составу и строению
Переходные формы – это организмы, сочетающие признаки строения эволюционно более древних и более поздних групп.
Филогенетические ряды – это ряды связанных родством ископаемых форм, например - филогенетический ряд лошадей.
Гомологичными называют органы, развивающиеся из одних зачатков, имеющие общий план строения и выполняющие как сходные, так и различные функции.
Аналогичные органы: чешуя акул и зубы млекопитающих. Аналогичные органы имеют абсолютно разное развитие и строение, хотя иногда могут иметь внешнее сходство, например, конечности крота и медведки.
Рудиментами являются остатки тазовых костей у безногой ящерицы желтопузика и змей (удавов), китообразных.
Примерами атавизмов служат: боковые пальцы на конечностях у лошади; полосатость у поросят домашних свиней; хвост, обильная волосатость всего тела, наличие дополнительных пар молочных желез у человека.
Австралия обособилась от Южной Азии свыше 100 миллионов лет назад ещё до возникновения высших млекопитающих. Животный мир Австралии наиболее отличен от обитателей других континентов.
ИНТЕРАКТИВНАЯ СХЕМА «КРИТЕРИИ ВИДА»
ОПРЕДЕЛЕНИЕ КРЕСТОЦВЕТНЫХ

2. Происхождение человека. |
ВАЖНО!
Происхождение человека
Все современные люди принадлежат к одному биологическому виду Homosapiens — человек разумный. Из полутора миллионов видов животных, известных науке, только человеку присущи во всей полноте такие свойства, как сознание, речь, абстрактное мышление. Развитие этих свойств человеческой психики в сочетании с трудовой деятельностью способствовало возрастанию роли социальных отношений в эволюции человека, обеспечивших ему экологическое превосходство над всеми живыми существами, способность заселить практически все регионы Земли и выйти в Космос.
Осознавая свою уникальность, люди издавна пытались объяснить свое происхождение. Эти попытки породили множество легенд, верований и сказаний. Развитие науки, ископаемые останки, обнаруженные за последнее столетие, позволили ответить на многие вопросы, касающиеся происхождения человека. Сегодня известно, как выглядели предки человека, где и когда они впервые появились, в каком направлении эволюционировали. Тем не менее многое в истории возникновения и эволюции человека остается неясным.
Приступая к научному объяснению происхождения человека, следует помнить, что любой биологический вид является по-своему уникальным. Степень уникальности вида определяется тем, насколько сходны с данным видом его ближайшие родственники из числа ныне живущих организмов, тем, какое количество родственных форм вымерло ранее, а также тем, насколько уникальными были процессы, имевшие место в эволюции данного вида.
Молекулярные, цитогенетические и сравнительно-анатомические исследования показывают, что в современной природе наиболее близкими человеку являются два вида шимпанзе. Далее в этой системе родства следуют горилла и орангутан. По критериям зоологической систематики человека и перечисленных человекообразных обезьян относят к отряду приматов.
Данные сравнительной анатомии. Во внешнем облике, в строении и расположении внутренних органов человека и человекообразных обезьян много общего. Имеющиеся анатомические различия между этими организмами менее значительны, чем между человекообразными и остальными обезьянами, и связаны они прежде всего с разницей в способе передвижения.
В связи с прямохождением таз человека превратился в опору для позвоночника, который стал более массивным в своей нижней части и приобрел S-образный изгиб. Большое затылочное отверстие переместилось в нижнюю часть черепа. Изменились пропорции конечностей. Стопа утратила хватательную способность. Кисть, напротив, стала более развитой, чем у обезьян. Вслед за изменениями скелета изменилось положение внутренних органов.
Цитогенетические данные. Диплоидное число хромосом у всех крупных человекообразных обезьян равно 48. У человека диплоидный набор представлен 46 хромосомами. Два плеча второй хромосомы человека соответствуют двум разным хромосомам обезьян (12-й и 13-й у шимпанзе, 13-й и 14-й у гориллы и орангутана). Вторая хромосома человека возникла в ходе эволюции в результате слияния двух негомологичных хромосом, имевшихся у общего предка человека и человекообразных обезьян и сохранившихся у последних вплоть до настоящего времени. Другие различия кариотипов касаются структуры отдельных хромосом и обусловлены главным образом произошедшими инверсиями их участков.
Данные молекулярной биологии. Последовательности аминокислот многих гомологичных белков человека и шимпанзе сходны более чем на 99%. Следствием этого являются близость групп крови, взаимозаменяемость многих белков (например, гормонов), сходные заболевания.
Важным открытием в области молекулярной биологии явилось установление постоянства скорости эволюции некоторых белков. Говоря об эволюции белка, подразумевают замены одних нуклеотидов на другие в гене, кодирующем этот белок. Скорость эволюции белка выражается в числе нуклеотидных замен, происходящих за единицу времени (млн лет). Если функция белка является очень специфичной и давно сложившейся, то такой белок эволюционирует в разных филогенетических линиях организмов приблизительно с постоянной скоростью. Этот факт позволяет оценить степень родства, а также установить последовательность и время дивергенции биологических видов. Примером таких белков служат белки — переносчики электронов в митохондриях.
Данные биологии развития. У детенышей шимпанзе есть признаки, свойственные человеку. С возрастом эти признаки у шимпанзе утрачиваются. Как и у людей, у детенышей шимпанзе тело покрыто редкими волосами. У них относительно крупный мозг (в сравнении с массой тела), защищенный выпуклым черепом. Кости черепа тонкие, не имеют сильно выраженных надглазничных валиков и затылочных гребней. Челюсти в меньшей степени выступают вперед, зубы небольшие. Затылочное отверстие расположено под средней частью черепа. Детеныши шимпанзе в возрасте до 3 лет способны гораздо лучше передвигаться на задних конечностях, чем взрослые особи.
Дивергенция человека и человекообразных обезьян на молекулярном и хромосомном уровнях выражена очень слабо. Если руководствоваться только молекулярно-биологическими и цитогенетическими данными, то человека и шимпанзе можно считать представителями одного рода. Тем не менее, огромные различия в поведении и деятельности, а также существующие морфологические различия заставили систематиков отнести человека и человекообразных обезьян не только к разным родам, но и к разным семействам. По-видимому, за те примерно 6—8 млн лет, которые прошли с момента дивергенции этих видов, человек эволюционировал чрезвычайно быстро в отношении морфологии и поведения, тогда как его молекулярная эволюция шла обычными темпами.
ПРЕДКИ ЧЕЛОВЕКА



СИСТЕМАТИЧЕСКОЕ ПОЛОЖЕНИЕ ЧЕЛОВЕКА
ГРУППА 305 ХИМИЯ 28-32
ТЕМА: Применение ацетилена на основе свойств.
ПРИМЕНЕНИЕ АЦЕТИЛЕНА
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварке и газовой резки), благодаря высокой температуре пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена:
- пропано-бутановые смеси
- городской газ
- природные газы
- водород
- пары бензина
- пары керосина
- МАФ
- и др.
По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при газовой резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени которых ниже, чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Влияние примесей в ацетилене на качество сварного шва
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей на качество сварного шва. Вредное влияние имеют следующие примеси:
- сероводород
- фосфористый водород
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Определить наличие сероводорода в ацетилене довольно легко, необходимо поднести фильтровальную бумагу, смоченную в растворе хлористой ртути под струю ацетилена. При наличии сероводорода - бумага побелеет.
Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Для определения наличия фосфористого водорода необходимо кусок фильтровальной бумаги, смоченный в десятипроцентном растворе азотнокислого серебра поднести под струю ацетилена. При содержании 0,01% фосфористого водорода бумага принимает отчетливую светло- желтую окраску, при содержании более 0,02% - бумага темнеет.
Химическим путем очистка ацетилена от фосфористого водорода производится путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Применение ацетилена в химической отрасли
Помимо газопламенной обработки ацетилен используют в области химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п. Далее мы рассмотрим, как ацетилен используется для получения тех или иных химических соединений.
Уксусный альдегид
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению:
HC = CH + H2O ? CH3 - CHО
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с применением ацетилена в качестве исходного продукта.
Ацетон
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
2C2H2 + 3H2O ? CH3-CО-CH3 + CО2 + H2О
Указанный процесс нашел применение в промышленных масштабах.
Хлористый винил
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
C2H2 + HCl ? CH2 = CHCl
Винилацетат
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
C2H3 + CH3COOH ? CH2 = CH-ОCО-CH3
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
Винилацетилен
При пропускании ацетилена через насыщенный раствор однохлористой меди и хлористого аммония при температуре 50°C образуется винилацетилен.
Реакция протекает по уравнению:
CH ? CH + CH ? CH ? CH ? C-CH ? CH2
В результате присоединения хлороводорода к винилацетилену образуется хлоропрен, который способен к быстрой и самопроизвольной полимеризации с образованием каучука высоких технических качеств.
Химия винилацетилена нашла широкое теоретическое обобщение, что позволило значительно расширить область применения этого продукта.
При взаимодействии ацетилена со спиртами в щелочном растворе образуются простые виниловые эфиры.
Так, например, реакция между ацетиленом и этиловым спиртом протекает по уравнению:
C2H2 + C2H5OH ? H2C = CH-O-C2H5
Эта реакция была открыта А. Е. Фаворским в 1887 г.
Подводя итог всему вышенаписанному, мы установили, что ацетилен получают не только из карбида кальция, но также путем сжигания метана. При этом выяснили, что ацетилен применяют не только для газовой сварки и газовой резки, но и в химической отрасли для получения пластмасс, растворителей и т. д.
Сварка и сварщик https://weldering.com/poluchenie-primenenie-acetilena
ТЕМА: Межклассовая изомерия с алкадиенами.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса "диен" к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
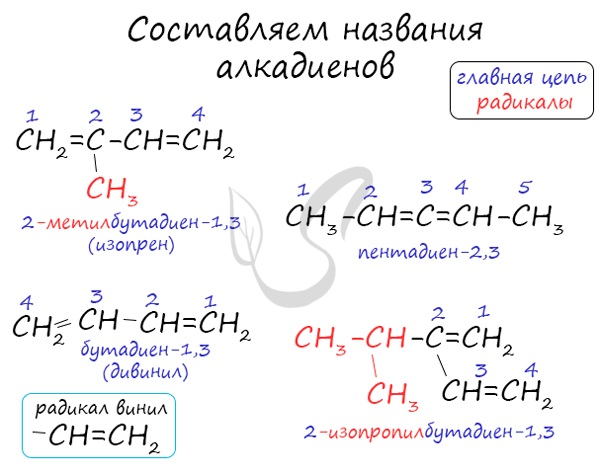
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
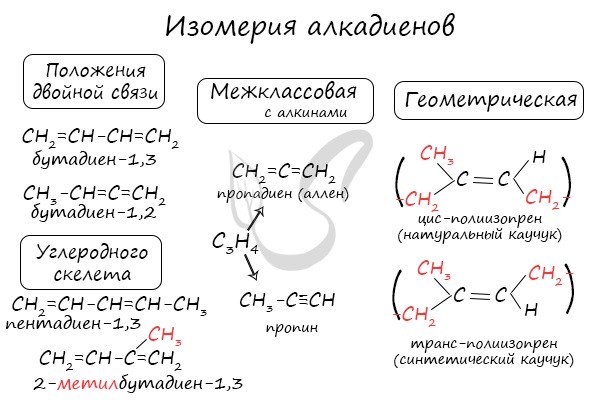
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
ТЕМА: С.р.-проверка знаний
ПРОВЕРЬТЕ СЕБЯ, ПРОЙДИТЕ ТЕСТ (С ПОДСКАЗКАМИ) ЗДЕСЬ:
https://studarium.ru/article-test/184
ТЕМА: Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение.
Одноатомные спирты - функциональная группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
o первичные R–CH2–OH,
o вторичные R2CH–OH,
o третичные R3C–OH.
Например:
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
o предельные (например, СH3 – CH2–OH)
o непредельные (CH2=CH–CH2–OH)
o ароматические (C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
1. Определение
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула: CnH2n+1OH или ROH или CnH2n+2O |
2. Гомологический ряд
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
4. Изомерия спиртов
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:
· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:
· межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
5. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
6. Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Видео-опыт: Физические свойства спиртов
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
Вывод:
1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
. |
ТЕМА:
|
ГРУППА 405 ХИМИЯ 48 ТЕМА: Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций. Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций. Уравнения окислительно-восстановительных реакций. Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов. Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса. Напишем уравнение реакции между алюминием и кислородом: Al + O2 = Al2O3 Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции. Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона: ` Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено: 4Al + 3O2 = 2Al2O3 Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
Составим схему электронного баланса: Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел. 2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде. Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор. ** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы. В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций – окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями. Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются. Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются. Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться. Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций. Различают три основных типа окислительно-восстановительных реакций: 1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления (когда окислитель и восстановитель – разные вещества); 2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество); 3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя). Рассмотрим примеры реакций трех типов. 1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции. Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс: Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”). Остальные коэффициенты подбираются без труда по уже найденным: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O 2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в ПРОМЕЖУТОЧНОЙ степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
Получаем уравнение: 2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O Или, складывая вместе моли HNO2: 3HNO2 = HNO3 + 2NO + H2O 3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
Это уравнение также подчиняется требованию электронного баланса: Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами: KClO3 = 2KCl + 3O2 Теперь ясно, что перед KClO3 надо поставить коэффициент 2. 2KClO3 = 2KCl + 3O2 Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории. Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны. Горение алюминия на воздухе. Алюминий - активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние - алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками. 4Al + 3O2 = 2Al2O3 Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель. Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей. |





































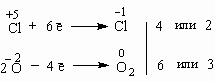

Комментариев нет:
Отправить комментарий