15.09.22 г. ЧЕТВЕРГ. 506,405
Здравствуйте, уважаемые студенты, заведите, пожалуйста тетрадь для конспектов по химии, другую- по биологии, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)
Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 506 ХИМИЯ 7,8,9
ТЕМА 7: Расчетные задачи на нахождение относительной молекулярной массы, определение массовой доли химических элементов в сложном веществе.
«Доля» означает часть от целого. Это универсальное математическое понятие. Например, кусок арбуза, изображенный на рисунке, составляет одну четвертую часть от целого арбуза, то есть его доля равна

Рис. 1. Понятие массовой доли
Как определить, какую массовую долю составляет тот или иной химический элемент в составе какого-либо химического соединения? Для этого надо обратиться к формуле этого соединения.
По химической формуле можно рассчитать массовые доли химических элементов в составе химического соединения.
Массовая доля химического элемента показывает, какая часть относительной молекулярной массы соединения приходится на данный химический элемент.
Массовые доли элементов
где
Например, требуется рассчитать массовые доли химических элементов в метане
Найдём относительную молекулярную массу метана:
По формуле рассчитаем массовые доли водорода и кислорода в составе метана:
Аналогично рассчитаем массовые доли химических элементов в азотной кислоте.
Найдём относительную молекулярную массу азотной кислоты
По формуле рассчитаем массовые доли водорода, азота и кислорода в составе азотной кислоты:
 Коротко о главном
Коротко о главном
Зная химическую формулу соединения, можно определить не только его качественный и количественный состав, но и найти массовые доли химических элементов.
Массовая доля химического элемента показывает, какая часть относительной молекулярной массы приходится на данный химический элемент.
Задание №1 Вычислите относительную молекулярную массу сульфата алюминия, химическая формула которого Al2(SO4)3. Алгоритм решения |
Дано: Al2(SO4) 3 | 1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав сульфата алюминия: Ar(Al)=27 2.Записываем формулу расчета Мr (Al2(SO4) 3) в общем виде: Мr (Al2(SO4) 3) = n1 *Аr (AI) + n2* Ar(S) + n3* Ar(O) n1- число атомов (моль атомов алюминия) n2- число атомов (моль атомов серы) n3- число атомов кислорода (моль атомов кислорода) 2.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем. Мr (Al2(SO4) 3 )= 27 * 2 + (32 + 16*4) * 3 = 342 |
Мr (Al2(SO4) 3)-? | Ответ: Мr (Al2(SO4) 3) =342 Не забывайте, что Мr величина безразмерная |
1- оксида железа (III) Fe2O3, гидроксида кальция Ca(OH)2,
2- оксида углерода (IV) CO2, азотной кислоты HNO3,
ТЕМА 8,9 :Периодический закон Д.И. Менделеева. Открытие Д.И. Менделеевым Периодического закона. Периодический закон в формулировке Д.И. Менделеева.Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).




- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
ГРУППА 405 ХИМИЯ 9,10
ТЕМА 9,10: Валентность. Химическое строение как порядок соединения атомов в молекулы по валентности. Изготовление моделей молекул органических веществ.
ТЕМА: Валентность.
Валентность -это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента, т.е., иными словами, это количество химических связей, которые атом данного химического элемента может образовывать с другими атомами.
Валентность углерода в органических соединениях равна IV. Этот тезис представляет собой одно из основных положений теории строения органических соединений А.М. Бутлерова.
Для углерода характерно наличие двух валентностей- высшей IV и низшей II. Однако, если изобразить структурные формулы органических веществ, не учитывая положения теории, валентность углерода будет представляться дробным числом, чего не может быть, поскольку величина валентности всегда является целым числом.
Согласно, теории строения органических соединений А.М. Бутлерова атомы в молекулах органических соединений связаны между собой в определенной последовательности, это означает, что атомы углерода могут быть связаны между собой, причем не всегда обязательно одинарными связями. Например:
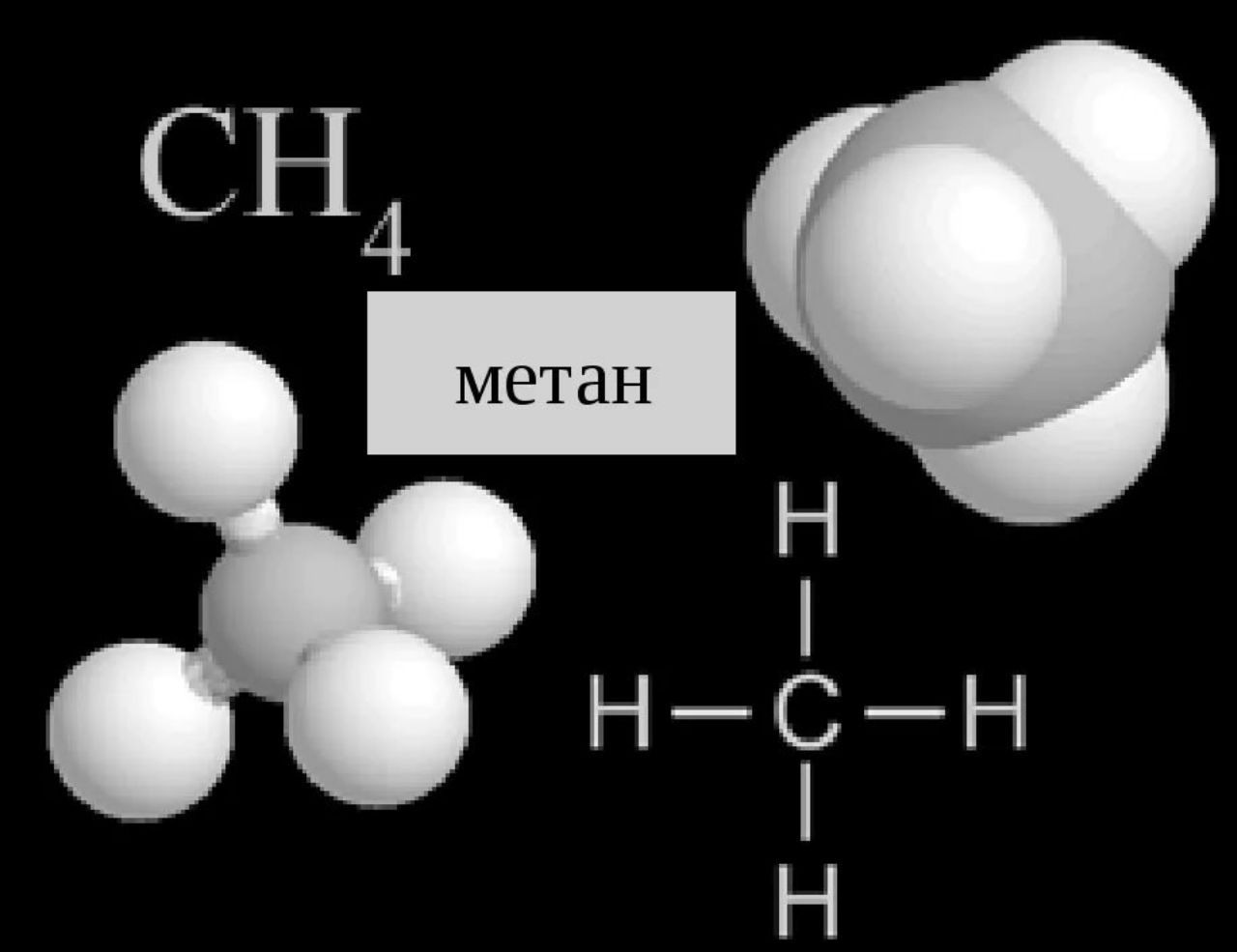
ТЕМА: Химическое строение как порядок соединения атомов в молекулы по валентности. Изготовление моделей молекул органических веществ.
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
- атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
- порядок соединения атомов в молекуле называется химическим строением;
- свойства веществ определяются не только их составом, но и химическим строением;
- атомы в молекулах оказывают взаимное влияние друг на друга;
- исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп
Способы отображения строения молекул. Формулы. Модели
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные (один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.

Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.

Молекулярная формула метана СН

Для состава С

Следовательно, веществ состава С
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:

Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».
Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображают масштабные (полусферические) модели:




Комментариев нет:
Отправить комментарий