01.11.22 г. ВТОРНИК. Гр.405,308
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи (ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать!) После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)
Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы.
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 405 химия 26,27
|
Натуральный и синтетические каучуки. Резина. Ознакомление с коллекцией каучуков и образцами изделий из резины. Натуральный и синтетические каучуки. Резина. Особенностью реакций присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как по месту разрыва двойной связи (1,2-присоединение), так и к крайним углеродным атомам (1,4-присоединение) . 1,2 присоединение: СН2= СН– СН =СН2 + Сl2 СН2Cl– СНCl– СН =СН2 1,4 присоединение: СН2= СН– СН =СН2 + Сl2 СН2Cl– СН= СН – СН2Cl Оба вида присоединения протекают параллельно. Выход того или иного продукта определяется условиями протекания реакции и характером реагента. Так атомарный водород присоединяется в положение 1,4, а молекулярный водород над катализатором – в 1,2 положение, либо происходит полное гидрирование . 1,2 присоединение: СН2= СН– СН =СН2 Н2СН3–СН2 – СН =СН2 Н2СН3–СН2 – СН2 – СН3 бутан 1,4 присоединение: СН2= СН– СН =СН2 2Н СН3– СН =СН – СН3 бутен-2 Запишите реакцию присоединения бромоводорода, учитывая правило Марковникова. Проверим себя. СН2= СН– СН =СН2 + HBr СН3 – СНBr– СН =СН2 3-бромбутен-1 (1,2 присоединение) СН2= СН– СН =СН2 + HBr СН2 Br–СН= СН– СН3 1-бромбутен-2 (1,4 присоединение) Реакции полимеризации идут преимущественно по 1,4 положениям, при этом получаются высокомолекулярные синтетические каучуки : nСН2= СН–СН =СН2 (–СН2– СН =СН – СН2 –)n бутадиен-1,3 бутадиеновый каучук nСН2= С–СН =СН2 (–СН2 – С = СН –СН2 –) n СН3 СН3 изопрен изопреновый каучук Запишите уравнение реакции получения хлоропренового каучука, если мономером для его получения является хлоропрен (2-хлорбутадиен-1,3). Проверим себя . nСН2= С–СН =СН2 (–СН2 – С = СН –СН2 –) n Сl Сl хлоропрен хлоропреновый каучук Каучуки бывают природные (натуральные) и синтетические. Учитель демонстрирует коллекции каучука, учащиеся отмечают в тетрадь свойства. Природный каучук является липким, эластичным, резиноподобным материалом. Синтетические каучуки обладают такими свойствами как: высокая износостойкость, устойчивость к многократным деформациям, высокая устойчивость к органическим растворителям (слайд 13). Заслушаем сообщение о «Знакомстве европейцев с каучуком» (приложение 1) (слайд 14) Каучуки – исходное сырье для получения резины. Процесс получения резины из каучука называют вулканизацией. Получающаяся резина содержит около 5% S, и по своим свойствам значительно превосходит исходный продукт. «Историю изобретения резины» мы узнаем из сообщения (приложение 2) Способы получения Бутадиен-1,3, изопрен и другие алкадиены имеют огромное промышленное значение, они служат сырьем для получения синтетических полимеров, производство которых составляет миллионы тонн в год. Рассмотрим промышленные способы получения алкадиенов (слайд 17-18): Дегидрирование: С бутадиен-1,3 С СН3 СН3 изопрен (2-метилбутадиен-1,3) Дегидратация и дегидрирование спиртов (метод Лебедева): С2Н5ОН 400-500 °С, Al2O3, ZnOСН2= СН–СН =СН2 + 2H2O + H2
Дегидрогалогенирование: C СН2= СН–СН =СН2 + 2KCl + 2 H2O 6. Направления применения Алкадиены применяются для производства каучука и резины, о них мы уже говорили. Для закрепления этого вопроса выполним упражнение 4 стр. 34 в рабочей тетради (Габриелян, О.С. Химия 10 класс: рабочая тетрадь к учебнику «Химия 10 класс. Базовый уровень») (слайд 19). При работе с интерактивной доской ученик может воспользоваться стрелками для соединения блоков схемы. Приложение 1 « Знакомство европейцев с каучуком» Каучук существует столько лет, сколько и сама природа. Окаменелые остатки каучуконосных деревьев, которые были найдены, имеют возраст около трёх миллионов лет. Каучук на языке индейцев тупи-гуарани означает «слёзы дерева» («кау» – дерево, «учу» – плакать, течь). Каучуковые шары из сырой резины найдены среди руин цивилизаций инков и майя в Центральной и Южной Америке, возраст этих шаров не менее 900 лет. Первое знакомство европейцев с натуральным каучуком произошло почти пять веков назад. Собственно, история каучука началась, как ни странно, с детского мячика и школьной резинки. В 1493 году корабль Христофора Колумба во время второго путешествия в Америку пристал к острову, названному именем Эспаньола (Гаити). Высадившись на берег, испанцы были удивлены весёлой игрой индейцев, похожей на наш баскетбол. Они в такт песне подбрасывали чёрные шары, которые, упав на землю, делали, словно живые, высокие и забавные прыжки. Взяв эти шары в руки, испанцы нашли, что они довольно тяжелы, липки и пахнут дымом. Индейцы скатывали их из загустевшего млечного сока, вытекавшего из порезов на коре дерева гевеи. Колумб привёз несколько кусков этого удивительного вещества на родину, но в те времена он никого не заинтересовал. Индейцы делали из него непромокаемые калоши, которые в жару прилипали к ногам, а, растянувшись, больше уже не сжимались. Много лет испанцы пытались повторить водонепроницаемые вещи (обувь, одежду, головные уборы) индейцев, но все попытки были неудачными. Первые попытки сделать каучуковую обувь вызывали только смех. Галоши или сапоги хорошо служили в дождь, но стоило выглянуть и припечь солнцу, как они растягивались, начинали прилипать. В мороз же такая обувь становилась хрупкой, как стекло. Следующие два века каучук для Европы был просто любопытной заморской диковинкой. В 1731 году правительство Франции отправило математика и географа Шарля Кондамина в географическую экспедицию по Южной Америке. В 1736 он отправил обратно во Францию несколько образцов каучука вместе с описанием продукции, производимой из него людьми, населяющими Амазонскую низменность. После этого резко возрос научный интерес к изучению этого вещества и его свойств. В 1770 году британский химик Джозеф Пристли впервые нашёл ему применение: он обнаружил, что каучук может стирать то, что написано графитовым карандашом. Тогда такие куски каучука называли гуммиластиком («смолой эластичной»). В 1791 году английский фабрикант Самуэль Пил запатентовал способ сделать одежду водонепроницаемой с помощью обработки её раствором каучука в скипидаре. Во Франции к 1820 г. научились изготовлять подтяжки и подвязки из каучуковых нитей, сплетённых с тканью. В Англии британский химик и изобретатель Чарльз Макинтош пропитал каучуком плотную материю, и она стала непромокаемой. Так появились первые плащи-макинтоши, а потом и первые галоши, и сумки для перевозки почты. Правда, потом стал очевиден большой недостаток всей этой продукции, делавший ее совершенно непригодной: в сильную жару материал становился слишком мягким, а в холодную погоду затвердевал, как камень. В США вещи из каучука стали популярными в 1830-х годах, резиновые бутылки и обувь, сделанные южноамериканскими индейцами, импортировались в больших количествах. Другие резиновые изделия завозились из Англии, а в 1832 году в городе Роксбери штата Массачусетс Джон Хаскинс и Эдвард Шафе организовали первую «каучуковую» фабрику в США. Открытие в 1839 году резины, полученной от нагревания каучука и серы, привело к широкому её применению. Внимание капиталистов всех стран обратилось на добычу каучука. Бразилия оказалась владетельницей громадных богатств. Чтобы сохранить их, правительство Бразилии издало закон, запрещающий под страхом смерти вывоз семян и молодых деревьев гевеи. Но было поздно. По совету ботаника Дж. Гукера, англичанин Викгем поехал в 1876 году на берега Амазонки, где собрал 70000 семян Гевеи и тайком доставил их в ботанический сад в Кью. Семена были высеяны, но взошло только 4%. Однако через несколько дней сеянцы достигли полуметровой высоты. Затем они были отправлены на остров Цейлон, а оттуда разосланы на Яву, в Бирму, Австралию и др. В нашей стране не было известно природных источников для получения натурального каучука, а из других стран каучук к нам не завозился. Впервые в промышленных масштабах синтетический каучук был получен выдающимся русским ученым С.В Лебедевым.
«История открытия вулканизации резины». История открытия Чарльзом Гудийром вулканизации резины – одна из самых запутанных и непостижимых историй. Этот человек не имел права на успех. Он не обладал нужными знаниями и подготовкой. Он сталкивался с трудностями, перед которыми спасовал бы любой другой. Часто он даже не знал, чего добивался. Гудийр начал опыты с бразильской эластичной смолой, изготовляя дома тонкие пленки при помощи скалки для теста. Он смешивал сырую смолу с любым попадавшимся под руку веществом: солью, перцем, сахаром, песком, касторовым маслом, даже с супом – следуя великолепному логическому заключению, что рано или поздно он перепробует все, что есть на земле, и наконец наткнется на удачное сочетание. Житель Нью-Хэвена Ральф Стил одолжил Гудийру денег, и тот открыл на них лавку. На полках красовались сотни пар галош. Но в первый же жаркий день они растаяли и превратились в дурно пахнущее месиво. Гудийр закрыл свою лавку и занялся опытами, смешивая с резиновой смолой множество веществ: орешник, сыр, чернила и все это никуда не годилось, за исключением магнезии. Когда он смещал фунт магнезии с фунтом резиновой смолы, получился материал белее резиновой смолы и гибкий и прочный, как кожа. Он изготовил из него обложки для книг, чехлы для роялей, показал публике, получил горячее одобрение, смеялся от радости – и через месяц убедился, что его вновь постигла полная неудача. В то время Гудийр думал, что его рецепт с магнезией можно еще как-то усовершенствовать. Он кипятил смесь смолы и магнезии в водном растворе негашеной извести и получал пласты резины, которая была гораздо глаже и прочнее прежней. Газеты восхваляли его как человека, спасшего резиновую промышленность. Но через три недели Гудийр обнаружил, что одной капли самой слабой кислоты – даже яблочного сока – было достаточно, чтобы нейтрализовать негашеную известь и разрушить материал. Многократные опыты требовали денег, и в итоге исследователь оказался в долговой тюрьме; именно там, продолжая опыты, он обнаружил, что липкость исчезает, если посыпать каучук серой и высушить его. Уже выйдя из тюрьмы, Гудийр, опять же по рассеянности, положил кусочек каучука с серой не на стол, а на горячую плиту. Ошибка оказалась открытием, потому что на плите Гудийр обнаружил не липкую смесь, а сухой мягкий упругий кусок… уже резины. Под действием серы при умеренном нагревании каучук приобретал большую прочность, твердость, становился менее чувствительным к переменам температуры. Процесс назвали вулканизацией, а вулканизированный каучук – резиной. Вот как описывала первые испытания нового материала дочь Гудийра: «Я случайно увидела, что отец держит у огня маленький кусочек резины, и заметила, что в тот день он был необычайно взволнован каким-то открытием. Он вышел из дома и прибил кусок гвоздем к стене. Стояли сильные холода. На следующее утро отец принес этот кусочек в дом и торжествующе поднял его над головой. Резина была такой же гибкой, как и раньше. Это доказывало ценность открытия». Вулканизация резины послужила толчком для развития электропромышленности, так как резина является прекрасным материалом для изоляции. Еще при жизни Гудийра в Соединенных Штатах, Англии, Франции и Германии выросли корпуса огромных фабрик, на которых работало более шестидесяти тысяч человек и изготовлялось пятьсот видов различных резиновых изделий, в общей сложности на 8 миллионов долларов в год. Окрыленный успехом, Гудийр стал тратить больше, чем зарабатывал. Он умер в 1860 году, оставив после себя двести тысяч долларов долгу, но друзья уже не считали его сумасшедшим. «Гудйер Тайр энд Раббер» (Goodyear Tyre and Rubber), резинотехническая фирма США. Основана в 1898. Главный производитель синтетического каучука в США, выпускает также военную продукцию; 1-е место в мире по производству шин. Тема: Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация. ТЕМА: Применение ацетилена на основе свойств. . АЛКИНЫ. АЦЕТИЛЕН. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА: ГОРЕНИЕ, ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ, ПРИСОЕДИНЕНИЕ ХЛОРОВОДОРОДА И ГИДРАТАЦИЯ. ПРИМЕНЕНИЕ АЦЕТИЛЕНА НА ОСНОВЕ СВОЙСТВ.На этом уроке вы сможете самостоятельно изучить тему «Алкины. Строение, номенклатура, изомерия, физические свойства, получение». В ходе урока вы узнаете о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомитесь с физическими свойствами алкинов, особенностями их строения. НОМЕНКЛАТУРА АЛКИНОВАлкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2. Номенклатура алкинов Тройную связь обозначают суффиксом -ин.
3,6-диметилгептадиин-1,4
Рис. 1. Шаростержневая модель ацетилена СТРОЕНИЕ АЛКИНОВАтомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу. Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.
Рис. 2. Образование тройной связи в молекуле ацетилена 3. ИЗОМЕРИЯ АЛКИНОВ1. Изомерия скелета 2. Изомерия положения тройной связи
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
Алкины не обладают геометрической изомерией. 4. ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ АЛКИНОВАцетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества. Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен. Получение алкинов 1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4 2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой: СаC2 + Н2О ¾¾¾→ Сa(OH)2 + C2H2. 3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:
1. Реакции гидрирования и галогенирования Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
Электрофильное присоединение Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора). Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью. 2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛКИНЫ1. Галогенирование. Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.
2. Гидрогалогенирование. Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
3. РЕАКЦИЯ КУЧЕРОВА3. Гидратация (реакция Кучерова) Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.
|
|
308 ХИМ ИЯ 31,32,33 Тема 31,32,33:Химические
элементы — неметаллы. Водородные
соединения неметаллов.Строение и
свойства простых веществ — неметаллов. Водородные соединения неметаллов. Физические свойства. Отношение к воде:
кислотно-основные свойства. Строение атомов неметаллов и их особенностиОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ НЕМЕТАЛЛОВОПРЕДЕЛЕНИЕ Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся выше этой линии, будут неметаллами. Неметаллы –химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость. ЭЛЕКТРОННОЕ СТРОЕНИЕ НЕМЕТАЛЛОВ И ИХ ОСОБЕННОСТИВ отличие от металлов, неметаллы имеют гораздо большее количество валентных электронов (электроны внешнего энергетического уровня), что дает им возможность в большинстве случаев проявлять себя в качестве окислителей (присоединять электроны) в ОВР. Чем меньше электронов необходимо присоединить атому неметалла до завершения внешнего уровня, тем большую окислительную способность он проявляет. Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы. Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях, чем металлы, поэтому иногда могут выступать в роли восстановителей в ОВР. Неметаллы образуют как одноатомные (инертные газы), так и двухатомные молекулы (азот, кислород, водород и галогены). Для многих неметаллов характерно явление аллотропии, т.е. существование элементов в виде нескольких простых веществ – аллотропных модификаций (углерод – алмаз, графит, фуллерены и т.д.; кислород и озон). ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧПРИМЕР 1
ПРИМЕР 2
При нормальных условиях в газообразном состоянии находятся водород, азот, фтор, хлор и инертные газы. Бром — единственный жидкий неметалл, остальные неметаллы — твёрдые вещества. Атомы инертных газов не соединены в молекулы, двухатомные молекулы простых веществ образуют водород Среди неметаллов распространено явление аллотропии. Аллотропия явление существования химического элемента в виде двух или нескольких простых веществ. Аллотропные видоизменения, сильно отличающиеся по своим физическим свойствам, образуют кислород, углерод, кремний, сера, фосфор, бор и другие неметаллы.
Элементы-неметаллы находятся в У большинства неметаллов на внешнем электронном уровне находится от трёх до семи электронов. Для неметаллов характерны высокие значения электроотрицательности. Самым электроотрицательным элементом является фтор. Для неметаллов не характерна общность физических свойств. Среди неметаллов распространено явление аллотропии. В зависимости от условий неметаллы могут проявлять в химических реакциях как окислительные, так и восстановительные свойства. Простые вещества — неметаллы образуют элементы главных подгрупп, расположенные в правой верхней части периодической системы (правее диагонали, соединяющей бор и астат). Для их атомов характерно наличие на внешнем уровне 4-8 электронов. Так, у азота на внешнем уровне 5 электронов (соответствует номеру группы), у кислорода — 6, у хлора — 7 электронов. Электроны в атомах этих элементов прочнее связаны с ядром, поэтому для неметаллов характерны такие физические свойства, как
Химические свойства НЕМЕТАЛЛОВ В реакциях с металлами и водородом неметаллы являются окислителями.
В реакциях с кислородом неметаллы являются восстановителями:
Галогены не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7. Фторид кислорода O+2F2−1 — соединение, в котором кислород проявляет положительную степень окисления Задача. Вычисление объема полученного газа, если известна масса исходного вещества.Объем газов рассчитывается по формуле: v = 22,4 л/моль • n, где 22,4 — молярный объем, т. е. объем одного моля любого газа, n — количество вещества (моль) Пример:СКОЛЬКО ЛИТРОВ ВОДОРОДА ВЫДЕЛИТСЯ ПРИ РАЗЛОЖЕНИИ ЭЛЕКТРИЧЕСКИМ ТОКОМ ВОДЫ МАССОЙ 72 Г?Решение:
Ответ: 89,6 л. НеметаллыНеметаллы – элементы, которые обладают неметаллическими свойствами и занимают положение в правом верхнем углу в таблице Менделеева. Каков же характер неметаллов, а также чем они отличаются от других соединений? ОБЩАЯ ХАРАКТЕРИСТИКА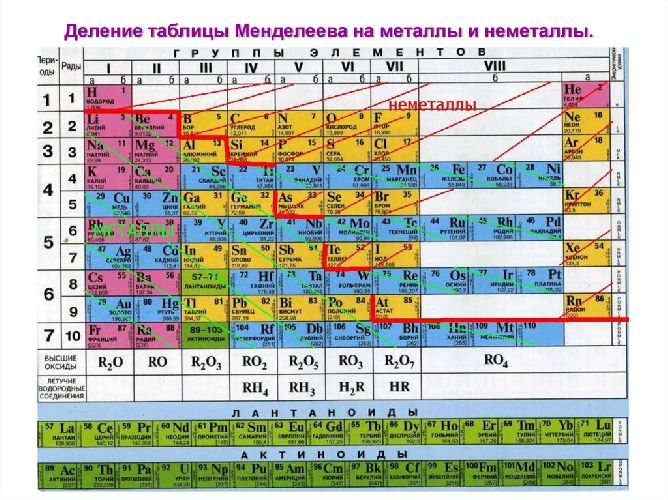 К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода. Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома). Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов. Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами. ФИЗИЧЕСКИЕ СВОЙСТВАДля большинства неметаллов простых веществ в твердом агрегатном состоянии характерна молекулярная кристаллическая решетка. То есть эти неметаллы являются кристаллическими веществами. Поэтому при обычных условиях они имеют вид газов, жидкостей или твердых веществ с низкими температурами плавления. Примерами таких веществ являются газы: водород H2 , неон Ne, жидкость – бром Br2 , твердые вещества йод I2, сера S8, фосфор P4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), которые имеют атомные кристаллические решетки.
Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера. ХИМИЧЕСКИЕ СВОЙСТВА И СОЕДИНЕНИЯВодородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом: S+H2 =H2 S (до 350 градусов равновесие смещено вправо) Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе. Неметаллы взаимодействуют с металлами и другими неметаллами: 2Na+Cl2 =2NaCl В результате получается натриевая соль соляной кислоты |

 Н
Н
 l
l











 Рис. 2. Неметаллы – жидкости, газы, твердые.
Рис. 2. Неметаллы – жидкости, газы, твердые.
Комментариев нет:
Отправить комментарий