ГРУППА 506 ХИМИЯ 19,20
Тема 19:Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь. Водородная связь. Образование водородной связи обусловлено спецификой водорода как элемента, атом которого состоит из протона и электрона. В соединениях водорода с атомами более электроотрицательных элементов на атоме водорода возникает частичный положительный заряд. Такой атом может взаимодействовать с неподеленными парами электронов атома электроотрицательного элемента соседней молекулы, в результате между молекулами возникает дополнительная межмолекулярная связь. Водородная связь – это связь, которая образуется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом сильно электроотрицательного элемента другой молекулы. Чем больше электроотрицательность атома, с которым соединяется атом водорода, тем больше энергия водородной связи. Водородная связь наиболее характерна для соединений фтора и кислорода, менее для соединений – азота. Образование водородной связи приводит к ассоциации (соединению) молекул. Рассмотрим образование водородной связи между двумя молекулами воды. В молекуле воды связь О-Н сильно полярная. На атоме кислорода сосредоточен отрицательный заряд, а на атомах водорода – положительный. Это приводит к притяжению атома водорода одной молекулы воды к атому кислорода другой молекулы – возникает водородная связь. В кристаллах льда, снега каждая молекула воды связана водородными связями с четырьмя соседними – за счет атомов водорода и двух неподеленных электронных пар атома кислорода. Следовательно, образование водородной связи обусловлено как электростатическим, так и донорно-акцепторным взаимодействием. В результате образуется ажурная (с большими пустотами) структура льда. Из-за этого плотность льда меньше, чем плотность воды. Способностью к ассоциации обладают молекулы как неорганических, так и органических соединений (вода, аммиак, спирты и др.) Водородная связь как и ковалентная, имеют направленность в пространстве и насыщаемость. Длина водородной связи больше длины обычной ковалентной связи, энергия – в 10-20 раз меньше. В связи с этим водородные связи малоустойчивы и довольно легко разрываются (например, при таянии льда и кипении воды). Но на разрыв этих связей требуется дополнительная энергия, поэтому температуры плавления и кипения веществ, в которых молекулы ассоциированы, оказываются выше, чем у подобных веществ, но без водородных связей. Например, между молекулами фтороводорода и воды образуются водородные связи, а между молекулами хлороводорода и сероводорода – практически нет. Водородная связь служит причиной некоторых важных особенностей воды – вещества, которое играет огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты, а поэтому имеет большое значение в химии жизненных процессов. 3. Газообразные, жидкие и твердые вещества. Из курса физики и повседневной жизни вам известно, что в зависимости от условий окружающей среды, и в первую очередь от температуры и давления, вещества могут находиться в одном из трех основных агрегатных состояний: газообразном, жидком и твердом. Каждое агрегатное состояние отличается от другого расположением частиц друг относительно друга и характером их движения. При переходе вещества из одного состояния в другое состав его частиц не изменяется, изменяется лишь их взаимное расположение. Газообразное состояние. В газообразном состоянии вещество не имеет собственной формы и объема. Оно занимает весь предоставленный ему объем и принимает форму сосуда. Газы обладают большой сжимаемостью и образуют однородные смеси. Эти свойства газов обусловлены тем, что расстояния между их молекулами в десятки раз превышают размер самих молекул. На таком расстоянии практически отсутствует межмолекулярное взаимодействие. Газообразное состояние характеризуется полной неупорядоченностью расположения молекул друг относительно друга. Молекулы в газах движутся хаотически. Если газы в смеси не реагируют между собой, то они сохраняют свою химическую индивидуальность, и поэтому многие физикохимические свойства таких систем могут быть выведены по правилу аддитивности: суммированием характеристик образующих их газов с учетом их мольных долей. Например, средняя молярная масса смеси газов X, Y, Z определяется так: М(Х + Y + Z) = х(Х) • М(Х) + X(Y) • М(Y) + *(Z) • М(Z), где х(Х), x(Y)> x(Z) — мольные доли газов X, Y, Z; М(Х), М(Y), М(Z) — молярные массы газов X, Y, Z. Четвертое агрегатное состояние — плазма, которая представляет собой ионизированный газ. Жидкое состояние В отличие от газов, в жидкостях молекулы расположены ближе друг к другу и удерживаются силами межмолекулярного взаимодействия (рис. 226). Это подтверждает, например, тот факт, что один объем воды образуется в результате конденсации 1300 объемов пара. Расстояние между частицами в жидкостях невелико, поэтому жидкости обладают незначительной сжимаемостью, при данной температуре им присущ определенный объем. Чтобы заметно уменьшить их объем, требуется очень большое давление. В то же время силы межмолекулярного притяжения в жидкостях недостаточно велики, чтобы придать им определенную форму. Молекулы в жидкости свободно перемещаются друг относительно друга, поэтому жидкости обладают текучестью и приобретают форму содержащего их сосуда. Следовательно, жидкости по структуре и свойствам занимают промежуточное положение между газообразными и твердыми веществами. С повышением температуры жидкости усиливается беспорядок во взаимном расположении частиц, что приближает их к газам. При понижении температуры упорядоченность внутренней структуры возрастает, что сближает их с твердыми веществами. Твердое состояние В твердом агрегатном состоянии среднее расстояние между образующими вещество частицами сопоставимо с их размерами, а энергия взаимодействия значительно превышает их среднюю кинетическую энергию. Частицы, образующие твердое вещество, не могут свободно перемещаться друг относительно друга, они лишь совершают колебательные движения около положения равновесия. Этим объясняются наличие у твердых веществ определенного объема и формы, их механическая прочность и незначительная сжимаемость. В зависимости от строения и физических свойств твердые вещества подразделяют на аморфные и кристаллические. Вещества в аморфном состоянии характеризуются некоторой упорядоченностью частиц, расположенных только в непосредственной близости друг от друга (так называемый ближний порядок), поэтому они изотропны, т. е. их физические свойства не зависят от направления. Проведем опыт. Нанесем на поверхность стекла тонкий ело расплавленного воска и дадим ему застыть. Коснемся застывшего вещества раскаленной иглой. Вокруг иглы воск расплавится. При этом пятно расплавленного воска примет форму круга. Следовательно, теплопроводность стекла не зависит от направления. Аморфные вещества не имеют определенной температур плавления. При нагревании они постепенно размягчаются, начинают растекаться и, наконец, становятся жидкими. При охлаж- дении они так же постепенно затвердевают. Аморфные вещества по структуре представляют собой переохлажденные жидкости. Подобно жидкостям они проявляют cвойства текучести, т. е. при длительном действии сравнительно не больших сил постепенно изменяют свою форму. Примерами веществ в аморфном состоянии могут служить стекла, смолы, клеи, большинство полимеров и т. д. Кристаллическое состояние Большинство твердых веществ в окружающем нас мире являются кристаллическими. Для этого состояния характерно строго определенное расположение частиц во всем объеме кристалл (дальний порядок), поэтому в отличие от аморфных кристаллические вещества обладают анизотропией, т. е. их физические свойства (прочность, теплопроводность и т. д.) неодинако вы в различных направлениях. Так, если вышеописанный опыт проделать на гладкой поверхности гипса, то пятно расплавленного воска примет форму эллипса. Значит, теплопроводность гипса в одном направлении более высокая, чем в других. Кристаллическое вещество в отличие от аморфного плавите; при строго определенной температуре, которую называют температурой плавления. Температура плавления — одно и важнейших физических свойств вещества, измеряя ее, можно определить чистоту данного вещества. ТЕМА 20: Чистые вещества и смеси. Понятие о смеси веществ. Гомогенные и гетерогенные смеси. Мы живем среди химических веществ. Мы вдыхает воздух, а это смесь газов (азота, кислорода и других), выдыхаем углекислый газ. Умываемся водой - это еще одно вещество, самое распространенное на Земле. Пьём молоко - смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный - лактоза. Едим яблоки, которые состоят из целого набора химических веществ - здесь и сахар, и яблочная кислота, и витамины... Когда прожеванные кусочки яблока попадают в желудок, на них начинают действовать пищеварительные соки человека, которые помогают усваивать все вкусные и полезные вещества не только яблока, но и любой другой пищи. Мы не только живем среди химических веществ, но и сами из них состоим. Каждый человек - его кожа, мышцы, кровь, зубы, кости, волосы построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар, витамины – вещества природного, естественного происхождения. Стекло, резина, сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина - искусственного происхождения, в природе их не было. Совершенно чистые вещества в природе не встречаются или встречаются очень редко. Чем же отличаются чистые вещества от смесей веществ? Индивидуальное чистое вещество обладает определённым набором характеристических свойств (постоянными физическими свойствами). Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными. Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов». Чистые вещества и смеси
Большинство окружающих нас объектов (тел) состоит не из индивидуальных веществ, а из их смесей. Смеси могут быть газообразными, жидкими, твёрдыми. Примерами смесей являются воздух, молоко, лимонад, морская и речная вода, сплавы металлов, плазма крови. Смесь всегда состоит из двух или более индивидуальных соединений. Смеси бывают однородными и неоднородными. Однородные (гомогенные) смеси смеси, в которых образующие их частицы нельзя обнаружить ни визуально, ни с помощью оптических приборов. Примерами однородных смесей являются раствор сахара или поваренной соли в воде, чистый воздух. Неоднородные (гетерогенные) смеси смеси, в которых образующие их частицы можно обнаружить визуально или с помощью оптических приборов Гранит и молоко — примеры неоднородных смесей. В граните невооружённым глазом можно различить его составные части — зёрна полевого шпата, кристаллы кварца и тёмные блестящие чешуйки слюды. Несмотря на то что молоко кажется однородным, при рассматривании под микроскопом в нём можно увидеть плавающие в воде капельки жира.
Рис. 1. Гранит и молоко под микроскопом
Чистые вещества всегда однородны и, в отличие от большинства смесей, имеют постоянный состав и постоянные температуры кипения и плавления. Это позволяет отличить чистое вещество от его смеси с другими веществами. Если наблюдать за температурой в процессе нагревания какого-либо чистого вещества, например льда, то можно заметить, что термометр будет фиксировать температуру Чистые жидкости кипят при строго определённой температуре. Например, если нагревать воду, то её температура сначала постепенно повышается. При температуре
Свойства отдельных компонентов в смеси сохраняются. Для чистых веществ характерно постоянство состава и свойств. Различают однородные (гомогенные) и неоднородные (гетерогенные) смеси. Смеси содержат отдельные компоненты в любых отношениях и не обладают постоянными свойствами.
Любое чистое вещество обладает индивидуальным химическим составом, который находит отражение в химической формуле. Чистому веществу соответствует определённый ряд физико-химических характеристик, строго индивидуальных для конкретного вещества. Именно по этим характеристикам (температуре кипения или плавления, электропроводности, показателю преломления и др.) можно идентифицировать чистое вещество. Смесь же состоит из нескольких чистых веществ, и свойства смеси могут меняться в зависимости от её количественного состава. Например, обратите внимание, что вкус воды из-под крана разный в разных городах. Кроме того, в одном городе шампунь и мыло смываются быстро и легко, а в другом городе может возникать ощущение, что мыло смываться не хочет. Это обусловлено разной жёсткостью воды, которая вызвана содержанием в ней различных солей кальция, магния и других металлов. Следовательно, вода из-под крана содержит не только индивидуальное вещество (дистиллированную воду), но и другие вещества (хлорид кальция, карбонат кальция, хлорид магния и т. д.). Чистые вещества (индивидуальные) можно также встретить в быту, например алюминиевая ложка, железный гвоздь, медная проволока. В то же время золотое или серебряное украшение не является чистым веществом — украшения всегда производятся из сплава металлов. | |||||||||||||||||||
ТЕМА
Реакции отщепления (дегидрирования, дегидрогалогенирования, дегидратации.
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:

- Дегидратация – отщепление молекулы воды:
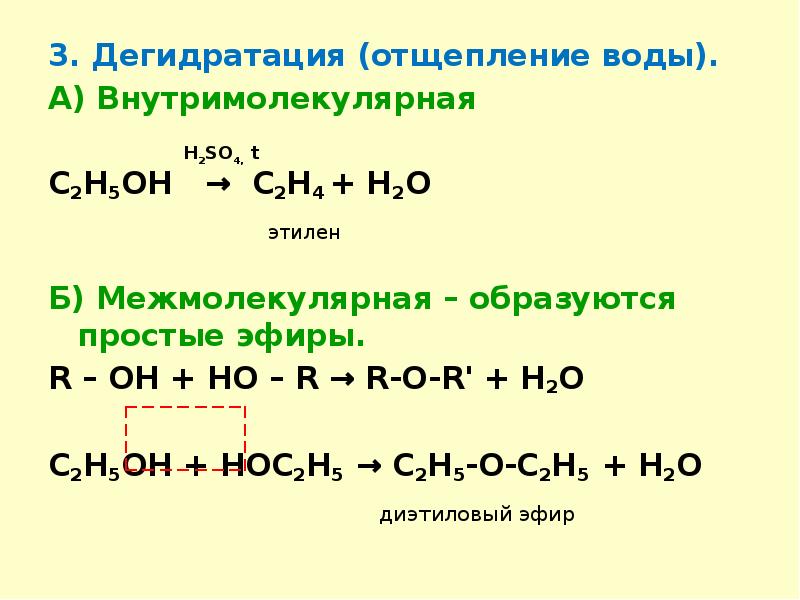

- Дегидрогалогенирования – отщепления молекулы галогеноводородов:
ТЕМА 12:РЕАКЦИИ ЗАМЕЩЕНИЯ. РЕАКЦИИ ИЗОМЕРИЗАЦИИ.
РЕАКЦИИ ЗАМЕЩЕНИЯ
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Крахмал, его строение, химические свойства, применение.
КРАХМАЛ, ЕГО СТРОЕНИЕ, ХИМИЧЕСКИЕ СВОЙСТВА, ПРИМЕНЕНИЕ
I. Фильм: “Полисахариды”
II. Физические свойства
Крахмал белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
III. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2
nC6H12O6 → (C6H10O5)n + nH2O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
IV. Строение
Состоит из остатков α - глюкозы.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 - 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Иллюстрация. Строение крахмала (амилоза, амилопектин)
Иллюстрация. Фрагмент молекулы крахмала.
Видео-опыт: "Кислотный гидролиз крахмала"
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
V. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
- Ценный питательный продукт.
- Для накрахмаливания белья.
- В качестве декстринового клея.
VI. Химические свойства полисахаридов
1. Гидролиз
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
2. Качественная реакция
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Видео-опыт: «Реакция крахмала с йодом»
Макромолекула амилозы представляет собой спираль,
каждый виток которой состоит из 6 звеньев α-глюкозы.При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
непрочитанные уроки
406 ТЕМА 12 Химическое строение как порядок соединения атомов в молекулы по валентности.
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
- атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
- порядок соединения атомов в молекуле называется химическим строением;
- свойства веществ определяются не только их составом, но и химическим строением;
- атомы в молекулах оказывают взаимное влияние друг на друга;
- исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп
Способы отображения строения молекул. Формулы. Модели
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные (один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.

Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.

Молекулярная формула метана СН

Для состава С

Следовательно, веществ состава С
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:

Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».
Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображают масштабные (полусферические) модели:




ДОПОЛНИТЕЛЬНОЕ ЗАДАНИЕ: ИЗГОТОВЬТЕ МОДЕЛЬ МОЛЕКУЛЫ ЛЮБОГО ОРГАНИЧЕСКОГО ВЕЩЕСТВА (ПО ЖЕЛАНИЮ, ИЗ ПОДРУЧНЫХ МАТЕРИАЛОВ:ПЛАСТИЛИН,СПИЧКИ, ЗУБОЧИСТКИ,ОРЕХИ ИТ.П.БУДЕТ ВЫСОКАЯ ОЦЕНКА)
ГРУППА 308 химия 24,25
урок 7 химия 406
ПРАКТИЧЕСКАЯ РАБОТА №2 |
Получение, собирание и распознавание газов.
Задачи
1
Условие:
Получение, собирание и распознавание водорода.
Решение:
При добавлении к цинку соляной кислоты наблюдается выделение бесцветного газа — водорода.
При поднесении к спиртовке слышен свистящий звук. Следовательно, водород не чистый, а смешан с воздухом.
Водород собирают в перевернутую пробирку, т. к. он легче воздуха.
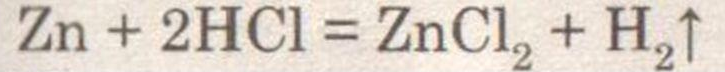
2
Условие:
Получение, собирание и распознавание кислорода.
Решение:
При добавлении оксида марганца (IV) пероксид водорода бурно разлагается.
При внесении в пробирку тлеющей лучинки, она разгорается, что свидетельствует о наличии кислорода.
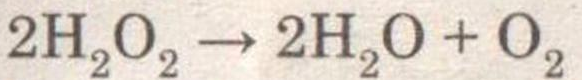
3
Условие:
Получение, собирание и распознавание углекислого газа.
Решение:
При добавлении раствора уксусной кислоты к мрамору (мелу) наблюдается бурное выделение углекислого газа.
При внесении в пробирку горящей лучины, она гаснет.
При пропускании углекислого газа через раствор известковой воды она мутнеет, а потом вновь становится прозрачной.
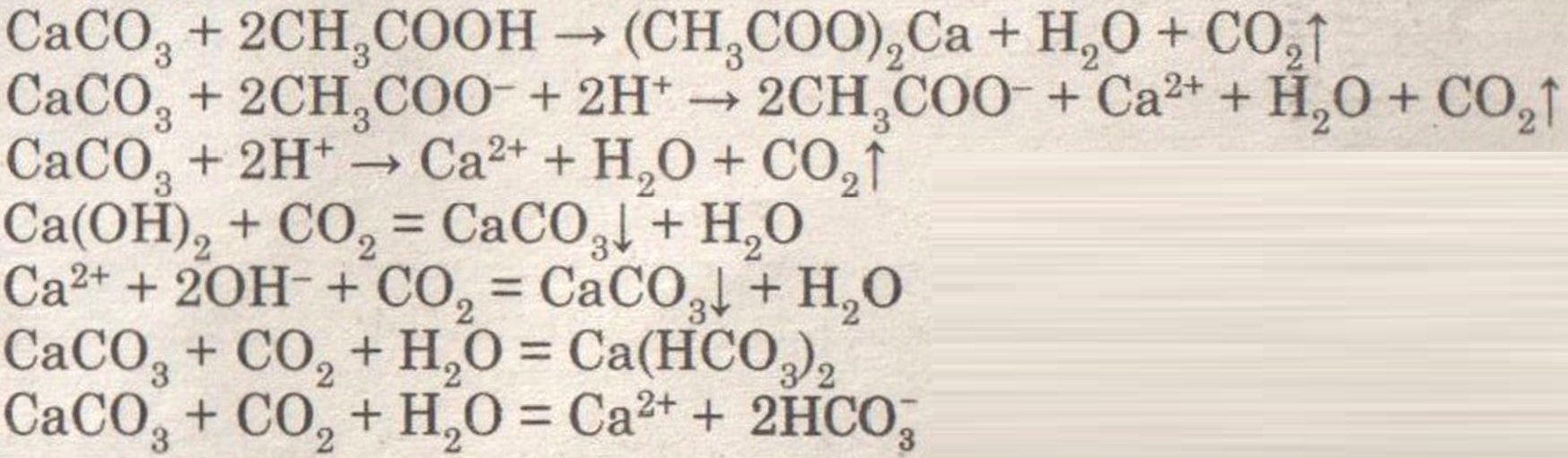
4
Условие:
Получение, собирание и распознавание аммиака.
Решение:
Ощущается запах аммиака.
Влажная лакмусовая бумажка синеет.
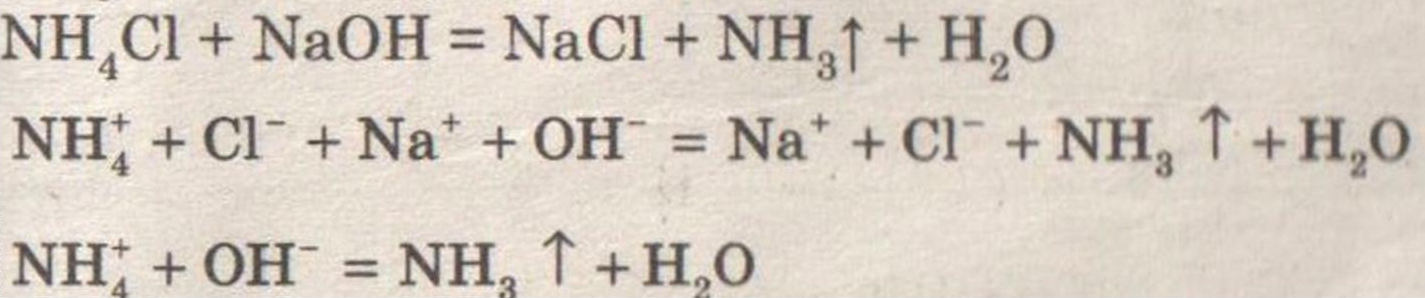
Аммиак имеет резкий запах!
Получение, собирание и распознавание газов. Решение экспериментальных задач. (ПОСМОТРИТЕ ПРЕЗЕНТАЦИЮ И ОФОРМИТЕ РАБОТУ, ЕЩЕ ИМЕЮТСЯ МАТЕРИАЛЫ ПО ЭТОЙ РАБОТЕ ВО ВКЛАДКЕ "ЛАБОРАТОРНЫЕ РАБОТЫ"














Комментариев нет:
Отправить комментарий