РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 23.01.23г.-27.01.23г.
Ср. 25.01: 406, 505, 401, ----
Пт. 27.01: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 401 ХИМИЯ 27,28
ТЕМА 27,28:Применение этилена на основе свойств.
Диены и каучуки. Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
| Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых СnН2n-2, называют диеновыми углеводородами, или алкадиенами, или диенами. |
В соответствии с третьим положением теории химического строения даже незначительные изменения в структуре вещества могут существенно изменить его химические свойства, а следовательно, сделать незаменимым для производства жизненно необходимых материалов. Не будь углеводородов этого класса, нам пришлось бы обходиться без резины и каучука, а точнее без всего бесчисленного ассортимента изделий, изготовленных из этих материалов.
Большое значение в производстве каучуков имеют диеновые углеводороды особого строения: в их молекулах две двойные связи разделены одной одинарной. Такие диены называют сопряжёнными диенами.
Простейший сопряжённый диен — бутадиен-1,3 имеет формулу СН2=СН—СН=СН2. Как видите, в международных названиях алкадиенов указывают номера обоих атомов углерода, от которых начинаются двойные связи в молекуле.
Ещё один важнейший диеновый углеводород — 2-метилбутадиен-1,3 (его чаще называют изопрен) имеет формулу 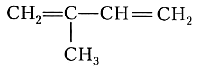
Способы получения алкадиенов
Для получения диеновых углеводородов в промышленности используют реакцию дегидрирования, т. е. отщепления водорода. В качестве исходного вещества берут предельный углеводород с тем же строением углеродной цепи, что и у получаемого продукта. Понятно, что для образования двух двойных связей С=С алкан должен отдать четыре атома, т. е. две молекулы водорода. Например, для синтеза изопрена в качестве исходного вещества необходимо взять 2-метилбутан: 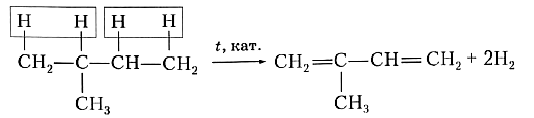
или 
Рассмотренная реакция наглядно показывает, что в составе алкадиенов на четыре атома водорода меньше, чем в молекулах соответствующих предельных углеводородов, и на два атома водорода меньше, чем в молекулах соответствующих алкенов.

(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Алкадиены. Химические свойства
Будучи непредельными углеводородами, алкадиены, подобно алкенам, склонны к реакциям присоединения. Они так же, как алкены, обесцвечивают бромную воду и раствор перманганата калия.
Особенность реакций присоединения диеновых углеводородов состоит в том, что две сопряжённые связи проявляют себя как единое целое. Присоединение галогена происходит не по одной двойной связи, а за счёт крайних атомов углерода сопряжённой системы двойных связей: 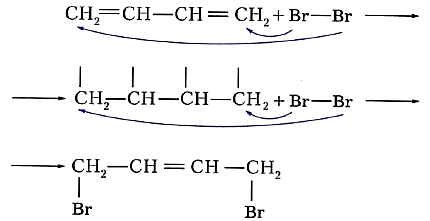
или ![]()
Продукт реакции 1,4-дибромбутен-2 также содержит двойную связь и, следовательно, тоже способен присоединять молекулу брома: ![]()
Аналогичным образом диеновые углеводороды присоединяют водород (реакция гидрирования): 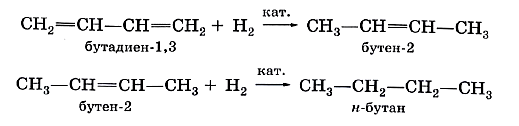
Каучук и продукты его вулканизации
Сопряжённые диеновые углеводороды способны к реакциям полимеризации, в результате которых получают синтетические каучуки.
Каучуки можно рассматривать как продукты полимеризации сопряжённых диенов или их производных. Каучуки относят к эластомерам. Такое название эти полимеры получили потому, что обладают эластичностью (от греч. elastikos — растяжимый), т. е. способностью обратимо изменять форму под действием внешних сил. Другие ценные свойства каучуков — водо- и газонепроницаемость — также широко используют в промышленном производстве.
Природными источниками каучука служат растения, богатые млечным соком: гевея, фикусы, молочаи, одуванчики. В промышленных масштабах натуральный (природный) каучук получают из сока тропического дерева гевеи. Такой каучук можно рассматривать как продукт полимеризации изопрена, или 2-метилбутадиена-1,3.
Чувствительность натурального каучука к перепадам температур и потерю при этом эластичности устраняет его вулканизация. Этот процесс заключается в «сшивании» полимерных цепей атомами серы при нагревании за счёт разрыва некоторой части двойных связей в этих цепях. Так получают резину. Если же «сшить» полимерные цепи каучука атомами серы за счёт разрыва подавляющего большинства двойных связей, то образуется эбонит, который уже не обладает эластичностью. Из него раньше изготавливали детали электрической арматуры, так как он хороший диэлектрик.
Каучуконосы нашей страны (одуванчики кок-сагыз и тау-сагыз) содержат очень мало млечного сока, а потому не могут использоваться в качестве источника натурального каучука. Проблему получения синтетического каучука решил коллектив учёных под руководством академика С. В. Лебедева в 1931 г. Этот каучук назвали бутадиеновым каучуком, поскольку в качестве мономера для его получения был выбран бутадиен-1,3. В процессе полимеризации двойные связи алкадиена разрываются, за счёт освободившихся валентностей крайних углеродных атомов растёт полимерная цепь. Одновременно с этим между центральными атомами углерода образуется двойная связь:
nСН2=СН—СН=СН2 → (—СН2—СН=СН—СН2—)„
Коллективом под руководством С. В. Лебедева был разработан также уникальный способ получения исходного диенового углеводорода — бутадиена-1,3 — на основе этилового спирта: 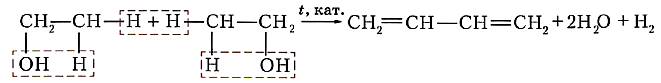
или ![]()
Эту реакцию называют реакцией Лебедева.
Синтетический бутадиеновый каучук обладает такими ценными качествами, как газо- и водонепроницаемость, однако уступает натуральному в эластичности.
В 60-х гг. прошлого столетия был получен эластичный синтетический каучук на основе изопрена — синтетический изопреновый каучук: 
По эластичности и износоустойчивости изопреновый каучук сходен с природным и так же, как бутадиеновый, используется для производства шин.
Общая формула СnH2n-2 отражает состав не только алкадиенов, но и ацетиленовых углеводородов. Речь о них пойдёт в следующем конспекте.
ГРУППА 505 ХИМИЯ 13,14
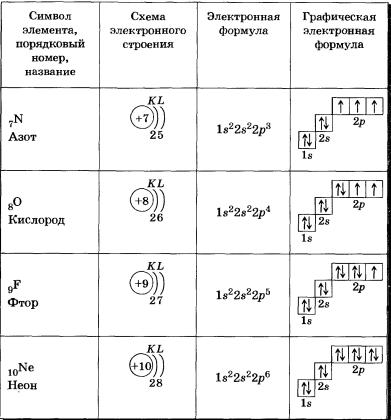
ТЕМА 13: Электронные конфигурации атомов химических элементов.Моделирование построения Периодической таблицы химических элементов.
ЗАДАНИЕ: ПРОЧИТАЙТЕ ВИМАТЕЛЬНО.
1. ПРЕПИШИТЕ И ВЫУЧИТЕ ПРАВИЛА ПАУЛИ И ХУНДА
2. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.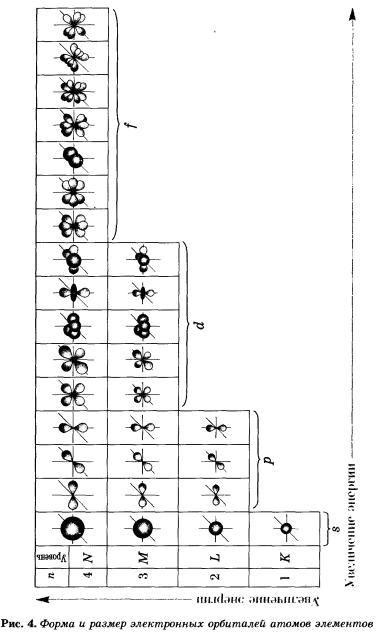
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой ор-битали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
11Nа 1s22s2Зв1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).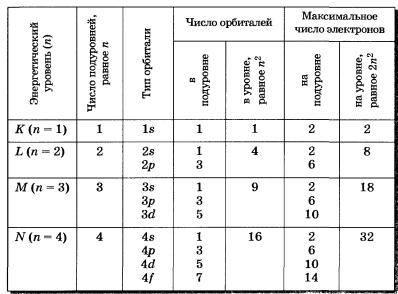
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
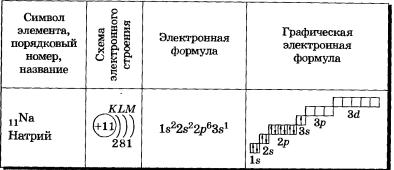
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
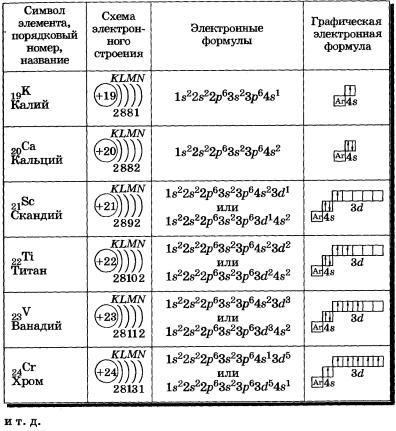
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода
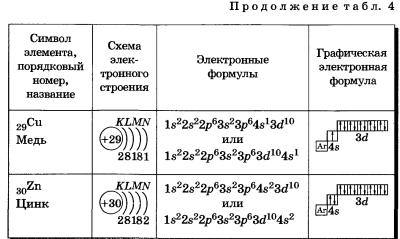
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.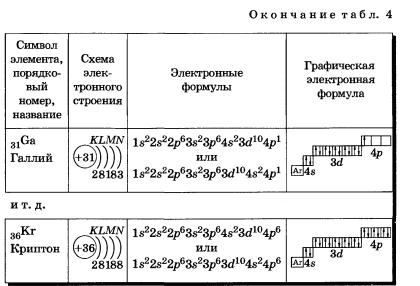
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
ТЕМА 14:Ионная химическая связь. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления.
Теория:







Ионная связь
 Питьевая сода
Питьевая сода Железный купорос
Железный купоросГРУППА 501 ХИМИЯ 31,32
ТЕМА 31,32:Алкины. Ацетилен. Химические свойства ацетилена: горение, обесцвечивание бромной воды, присоединение хлороводорода и гидратация.
Применение ацетилена на основе свойств.
АЛКИНЫ. АЦЕТИЛЕН. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА: ГОРЕНИЕ, ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ, ПРИСОЕДИНЕНИЕ ХЛОРОВОДОРОДА И ГИДРАТАЦИЯ. ПРИМЕНЕНИЕ АЦЕТИЛЕНА НА ОСНОВЕ СВОЙСТВ.
На этом уроке вы сможете самостоятельно изучить тему «Алкины. Строение, номенклатура, изомерия, физические свойства, получение». В ходе урока вы узнаете о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомитесь с физическими свойствами алкинов, особенностями их строения.
НОМЕНКЛАТУРА АЛКИНОВ
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
 | |
| ацетилен (этин) | бутин-1 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.

3,6-диметилгептадиин-1,4

Рис. 1. Шаростержневая модель ацетилена
СТРОЕНИЕ АЛКИНОВ
Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.

Рис. 2. Образование тройной связи в молекуле ацетилена
3. ИЗОМЕРИЯ АЛКИНОВ
1. Изомерия скелета
2. Изомерия положения тройной связи
| бутин-1 | бутин-2 |
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
 |  | |
| бутин-1 | бутадиен-1,3 | циклобутен |
Алкины не обладают геометрической изомерией.
4. ФИЗИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ АЛКИНОВ
Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества.
Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен.
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4![]() С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + Н2О ¾¾¾→ Сa(OH)2 + C2H2.
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:

1. Реакции гидрирования и галогенирования
Гидрирование алкинов протекает в тех же условиях, что гидрирование алкенов. В зависимости от количества водорода может образоваться алкен или алкан.
![]()
![]()
Электрофильное присоединение
Алкины менее активны в электрофильном присоединении, чем алкены. Почему? Потому что тройная связь короче и прочнее, чем двойная. Поэтому в некоторых случаях для осуществления реакции необходимы специальные условия (например, присутствие солей ртути в качестве катализатора).
Реакции присоединения к алкинам могут проходить в два этапа: на первом образуется вещество с двойной связью.
2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛКИНЫ
1. Галогенирование.
Обесцвечивание бромной воды – качественная реакция на алкины, так же как на алкены.


2. Гидрогалогенирование.
Присоединение хлороводорода к ацетилену приводит к образованию винилхлорида (хлорэтена) – мономера для синтеза распространенного материала поливинилхлорида (ПВХ):
![]()
3. РЕАКЦИЯ КУЧЕРОВА
3. Гидратация (реакция Кучерова)
Реакция проходит в кислой среде в присутствии солей ртути. Образующийся на первой стадии фенол перегруппировывается в карбонильное соединение.


4. ПОЛУЧЕНИЕ АЦЕТИЛЕНА В ЛАБОРАТОРИИ
Кислотные свойства алкинов
Алкины, у которых при тройной связи есть атом водорода, проявляют свойства очень слабых кислот. Они реагируют, например, с водно-аммиачными растворами солей Cu(I) и Ag(I). Атом водорода замещается на атом металла, выпадает осадок соли, которая называется ацетиленидом.
![]()
Ацетиленид меди – темно-красный, а ацетиленид серебра – желтый или белый. Это можно использовать при определении алкинов с концевой тройной связью.
Окисление алкинов
1. Обесцвечивание подкисленного раствора перманганата калия – качественная реакция на соединения с кратной связью. Рис. 1.
5HCºCR + 8KMnO4 + 24HCl ®5CO2 + 5RCOOH + 8MnCl2 + 8KCl + 12H2O.
2. На воздухе алкины горят коптящим пламенем:
2С2Н2 + 5О2 = 4СО2 + 2Н2О.

Рис. 1. Обесцвечивание КМnO4
Применение алкинов
Благодаря яркому пламени в XIX веке широко распространились ацетиленовые фонари.
При горении смеси ацетилена с кислородом температура пламени достигает 2800–3000оС – можно плавить многие металлы. На этом свойстве основана ацетиленовая сварка. Рис. 2, 3.

Рис. 2. Ацетиленовая горелка

Рис. 3. Сварка и резка металлов
Кроме того, ацетилен используют в промышленном органическом синтезе для получения винилхлорида, акрилонитрила, винилацетилена – исходных веществ при производстве распространенных полимеров.
Подведение итога урока
На этом уроке вы изучили тему «Алкины. Химические свойства и применение». Вы смогли узнать, что представляют собой алкины и какими химическими свойствами характеризуется этот класс соединений. Вы узнали о том, как свойства алкинов влияют на их практическое применение.

Комментариев нет:
Отправить комментарий