РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 06.01.23г.-10.01.23г.
Пн.06,02: 306, 401, 401, 408
Вт. 07,02: 508, 505, 505, 501
Ср. 08.02: 406, 505, 401, ----
Чт. 09.02: 505, 501, 306, 508
Пт. 10.02: 401, 505, ----, 501
Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com . Тетрадь привезете, когда перейдем на очную форму обучения.)Справа находится АХИВ БЛОГА , смотрите дату и номер своей группы
моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
ГРУППА 401 ХИМИЯ 35,36
ТЕМА 35:Спирты. Получение этанола брожением глюкозы и гидратацией этилена. Гидроксильная группа как функциональная. Понятие о предельных одноатомных спиртах. Химические свойства этанола: взаимодействие с натрием, образование простых и сложных эфиров, окисление в альдегид. Применение этанола на основе свойств. Алкоголизм, его последствия и предупреждение.
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
o одноатомные (одна группа -ОН)
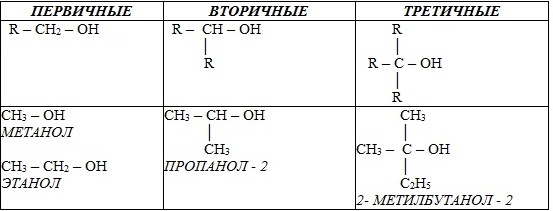
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
o многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
o первичные R–CH2–OH,
o вторичные R2CH–OH,
o третичные R3C–OH.
Например:
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
o предельные (например, СH3 – CH2–OH)
o непредельные (CH2=CH–CH2–OH)
o ароматические (C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
1. Определение
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула: CnH2n+1OH или ROH или CnH2n+2O |
2. Гомологический ряд
3. Номенклатура спиртов
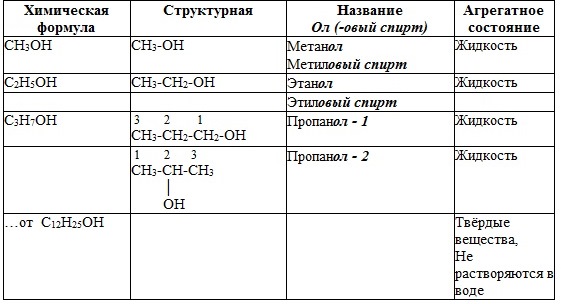
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
4. Изомерия спиртов
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:
· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:
· межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
5. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
6. Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Видео-опыт: Физические свойства спиртов
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
Вывод:
1) В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
ТЕМА 36:Глицерин как представитель многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение глицерина
Растворение глицерина в воде и взаимодействие с гидроксидом меди(II).
ГРУППА 505 ХИМИЯ 21,22
ТЕМА 21: Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Смесь – структура, образующаяся из двух и более веществ.
Вещества, входящие в состав смеси, называют компонентами.
Например, воздух – смесь азота, кислорода, углекислого газа и других.
Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью.
Например, воздух может быть загрязнен угарным газом.
Массовая доля в жидких и твердых смесях рассчитывается по формуле:
Массовая доля в смеси газов (φ) рассчитывается по формуле:
Задача. В 10 мл дистиллированной воды растворили 1 г поваренной соли. Найдите массовую долю растворенного вещества.
Найти массу раствора. m (р-ра) = m (H2O) + m (NaCl) = 10 г + 1 г = 11 г
Найти массовую долю соли. ω (NaCl) = (1 г/11 г) * 100 % = 9,09 %
Ответ: ω (NaCl) = 9,09 %
Задача. В 4 л растворе содержится 100 г соляной кислоты HCl.
Рассчитайте массовую долю растворенного вещества, учитывая, что плотность соляной кислоты – 1,098 г/мл.
Найти массу вещества. m(р-ра) = V * p = 4000 мл * 1,098 г/мл = 4392 г
Найти массовую долю кислоты. ω (НCl) = (100 г/4392 г) * 100 % = 2,277 %
Ответ: ω (НCl) = 2,277 %
Задача. К 700 г 48%-ного раствора добавили 30 г это же соли, которая находится в растворе. Определите массовую долю в полученной смеси?
Найти массу раствора.
m(р-ра) = 700 г + 30 г = 730 г
Найти массу растворенного вещества в исходном растворе.
m1(соли) = 700 г * 48 %/ 100 % = 336 г
Найти массу вещества в полученном растворе. m2 (соли) = 336 г + 30 г = 366 г
Найти массовую долю соли в растворе.
ω (соли) = 366 г * 100 %/ 730 г = 50,137 %
Ответ: ω (соли) = 50,137 %

Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.

Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
| Твёрдые частички | Капли жидкости | Пузырьки газа | |
| В твердом теле | Сплав | Капиллярная система | Твёрдая пена, порошок |
| В жидкости | Суспензия | Эмульсия | Пена |
| В газе | Аэрозоль | Туман | Неустойчиво |
Основные способы разделения смеси
Существуют различные методы разделения смесей. Для газов эти методы основаны на разнице в скоростях либо массах молекул веществ, входящих в смесь.
ТЕМА 22: Дисперсные системы. Понятие о дисперсной системе. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Понятие о коллоидных системах.
ГРУППА 501 ХИМИЯ 38,39
ТЕМА 38:Основания и их свойства. Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований.
ПЛАН
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH-
Ca(OH)2 ® CaOH+ + OH- ® Ca2+ + 2OH- -
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
- В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН- в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH- + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH- + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O
OH- + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH- + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-).
С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид - ионов ОН-.
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью:
NaOH ® Na+ +
Многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 ® BaOH+ +
Ba(OH)+ Ba2+ +
Cтупенчатой диссоциацией оснований объясняется образование основных солей.
Получение
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2
+ CI2
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Нерастворимые основания
Определение Нерастворимые основания ― основания, в составе которых нет активных металлов (подгруппы Ia и IIа ниже магния).
Получение • Способ получения нерастворимых оснований ― соль + щелочь: Fe(NO3)3 + 3NaOH → Fe (OH)3↓ + 3NaNO3 Fe3+ + 3OH- → Fe(OH)3 • Нерастворимые основания нельзя получить из соответствующего оксида и воды ― они не реагируют (искл.оксид магния). MeO + H2O — не реагирует Неактивный Классификация нерастворимых оснований • основные • амфотерные нерастворимые основания основные амфотерные формула MeOH +1; +2 (кр. искл) MeOH +3; +4; (+2) искл. разлагаются при повышении температуры Cu(OH)2 → CuO + H2O синий черный во влажном состоянии Zn(OH)2 → ZnO + H2O реагируют с кислотами Mg(OH)2 + 2HCl → MgCl2 +2H2O Mg(OH)2 + 2H+ → Mg2+ + 2H2O Be(OH)2 + 2HCl → BeCl2 + 2H2O Be(OH)2 + 2H+ → Be2+ + 2H2O реагирует со щелочами в растворе NaOH + Al(OH)3 → Na[Al(OH)4] OH- + Al(OH)3 → [Al(OH)







Комментариев нет:
Отправить комментарий