Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 13.03.23г. - 17.03.23г.
Пн.13.03: 306, 401, 401, 403
Вт. 14.03:508, 505, 505, 501
Ср. 15..03: 406, 403, 401, 501
Чт. 16.03: .., 501, 306, 508
Пт. 17.03: 505, ..., 501
ГРУППА 505 ХИМИЯ 40,41
ТЕМА 40 :Разложение нерастворимых в воде оснований. Основные способы получения оснований.
Среди нерастворимых в воде оснований следует выделить особую группу веществ – амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения амфотерных оснований такие же, как и нерастворимых оснований.
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щелочи:
CuSO4 + 2NaOH = Cu(OH)2![]() + Na2SO4.
+ Na2SO4.
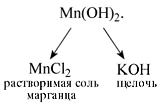
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца(II). До реакции составные части нерастворимого основания Mn(OH)2 находились в составе растворимых веществ – соли марганца (например, MnCl2) и щелочи (например, KOH):
Уравнение реакции:
MnCl2 + 2KOH = Mn(OH)2 + 2KCl.
Задание 2.24. Напишите уравнения реакций, при помощи которых можно получить:
а) гидроксид железа(III); б) гидроксид железа(II).
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей. Нерастворимые в воде основания не реагируют с растворами солей, а также с амфотерными и некоторыми кислотными оксидами.
• Нерастворимые основания реагируют с кислотами. При этом происходит растворение исходного нерастворимого вещества (осадка). Например:
![]()
Таким образом, подобные реакции возможны, если образуется растворимая соль.
• Нерастворимые основания разлагаются при нагревании. При этом чем меньше активность металла (см. ряд напряжений), тем легче разлагается основание на оксид и воду:
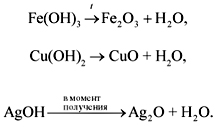
Свойства амфотерных гидроксидов
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
![]()
Амфотерные вещества проявляют двойственные свойства, они реагируют и с кислотами, и с щелочами (при этом амфотерные гидроксиды растворяются):
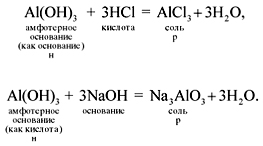
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2)* образуется сложное комплексное соединение: Na3[Al(OH)6] или Na[Al(OH)4]
ТЕМА 41 :Соли и их свойства. Взаимодействие со.лей с металлами. Взаимодействие солей друг с другом.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или NH4+) и анионы кислотных остатков.
BaCl2→ Ba2+ + 2Cl- K2CO3 →2K+ + CO32-
Химические свойства солей:
1.Взаимодействие солей с металлами (более активный металл - стоящий в ряду напряжений металлов левее - вытесняет менее активный металл из раствора его соли):
Fe + CuSO4 FeSO4 + Cu Fe + Cu2+ +SO42- Fe2++SO42- + Cu Fe + Cu2+ Fe2++ Cu
2. Взаимодействие солей с щелочами (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
CuSO4+2NaOH → Cu(OH)2↓+ Na2SO4
Cu2++SO42- +2Na+ +2OH-→Cu(OH)2↓+2Na++ SO42-
Cu2+ +2OH- → Cu(OH)2↓
3.Взаимодействие солей с солями (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
NaCl +AgNO3 AgCl + NaNO3 Na+ + Cl- + Ag+ + NO3- AgCl + Na + +NO3- Ag+ + Cl- AgCl
4. Взаимодействие солей с кислотами (реакция возможна, если в результате реакции образуется осадок, газ, слабый электролит)
HCl +AgNO3 AgCl + HNO3 H+ + Cl- + Ag+ + NO3- AgCl + H+ +NO3- Ag+ + Cl- AgCl
CO2
Na2CO3+2HCl → 2 NaCl+H2CO3
H2O
2Na+ +CO32- +2H+ + 2Cl- → 2Na+ + 2Cl- + CO2↑+ H2O
CO32- +2H+→ CO2↑+H2O
ГРУППА 501 ХИМИЯ 52,53



Комментариев нет:
Отправить комментарий