ПОНЕДЕЛЬНИК, 16.11.20г. 305,303,308,301,108 группы
ГРУППА 305
Тема урока: Основные законы химии. Стехиометрия. Закон сохранения массы веществ. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия их него.
Законы стехиометрии
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
В основу составления химических уравнений положен метод материального баланса, основанный на законе сохранения массы (М. В. Ломоносов, 1748, А. Лавуазье, 1789).
Закон сохранения массы веществ : Масса реагирующих веществ равна массе продуктов реакции.
В химической реакции число взаимодействующих атомов остается неизменным, происходит только их перегруппировка с разрушением исходных веществ. Взаимодействие водорода и кислорода с образованием воды может быть записано с помощью уравнения химической реакции
|
Коэффициенты перед формулами химических соединений называются стехиометрическими.
Закон постоянства состава (Ж. Пруст): Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.
Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах; их составы N 2O, NO, N 2O 3, NO 2, N 2O 5.
Закон эквивалентов (И. Рихтер): В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
Закон Авогадро : В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
- Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем.
- Относительная плотность одного газа по другому равна отношению их молярных масс.
Число Авогадро – число частиц в моле любого вещества; N A = 6,02∙10 23 моль –1.
Молярный объем – объем моля любого газа при нормальных условиях; равен 22,4 л∙моль –1.
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль –1.
ГРУППА 303
Тема урока: Агрегатные состояния веществ и водородная связь. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Водородная связь.
Агрегатное состояние
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Почему происходят такие превращения?
Все вокруг состоит из атомов и молекул. Атомы и молекулы различных веществ взаимодействуют друг с другом, и именно связь между ними определяет, какое у вещества агрегатное состояние.
Выделяют четыре типа агрегатных веществ: газообразное, жидкое, твердое, плазма.
Переход из одного агрегатного состояния в другое, а также броуновское движение или диффузия относятся к физическим явлениям, поскольку в этих превращениях не происходит изменений молекул вещества и сохраняется их химический состав.
Газообразное состояние
На молекулярном уровне газ представляет собой хаотически движущиеся, сталкивающиеся со стенками сосуда и между собой молекулы, которые друг с другом практически не взаимодействуют. Поскольку молекулы газа между собой не связаны, то газ заполняет весь предоставленный ему объем, взаимодействуя и изменяя направление только при ударах друг о друга. К сожалению, невооруженным глазом и даже с помощью светового микроскопа увидеть молекулы газа невозможно. Однако газ можно потрогать.
Если накачать воздухом шину автомобиля или велосипеда, и из мягкой и сморщенной она становится накачанной и упругой. Это происходит потому, что в замкнутый ограниченный объем шины попадает большое количество молекул, которым становится тесно, и они начинают чаще ударяться друг о друга и о стенки шины, а в результате суммарное воздействие миллионов молекул на стенки воспринимается нами как давление.
Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума. Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить, как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга. Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно. Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное. Испарение — это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела. Испарение с поверхности твердых тел называется сублимацией или возгонкой. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества. Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем — это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется. Однако многие видели, как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле. Еще одно свойство жидкости — вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости — взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.
Твёрдое состояние
Если у жидкости, в отличие от газа, молекулы движутся уже не хаотически, а вокруг определенных центров, то в твёрдом агрегатном состоянии вещества атомы и молекулы имеют четкую структуру и похожи на построенных солдат на параде. И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму. Между твердыми и жидкими телами существует промежуточная группа аморфных веществ, представители которой с одной стороны за счет высокой вязкости долго сохраняют свою форму, а с другой – частицы в нем строго не упорядочены и находятся в особом конденсированном состоянии. К аморфным веществам относится целый ряд веществ: смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид, полимеры, сургуч, различные клеи, эбонит и пластмассы.
При определенных условиях вещества, находящиеся в агрегатном состоянии жидкости, могут переходить в твердое, а твердые тела, наоборот, при нагревании плавиться и переходить в жидкое. Это происходит потому, что при нагревании увеличивается внутренняя энергия, соответственно молекулы начинают двигаться быстрее, а при достижении температуры плавления кристаллическая решетка начинает разрушаться и изменяется агрегатное состояние вещества. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, выделяют следующую структуру: молекулярную, атомную, ионную металлическую.
Повторите тему «Кристаллические решётки»
У одних веществ изменение агрегатных состояний происходит легко, как, например, у воды, для других веществ нужны особые условия (давление, температура). Но в современной физике ученые выделяют еще одно независимое состояние вещества — плазма.
Плазма — ионизированный газ с одинаковой плотностью как положительных, так и отрицательных зарядов. В живой природе плазма есть на солнце, или при вспышке молнии. Северное сияние и даже привычный нам костер, согревающий своим теплом во время похода на природу, также относится к плазме. Искусственно созданная плазма добавляет яркости любому городу. Огни неоновой рекламы — это всего лишь низкотемпературная плазма в стеклянных трубках. Привычные нам лампы дневного света тоже заполнены плазмой.
Плазму делят на низкотемпературную — со степенью ионизации около 1% и температурой до 100 тысяч градусов, и высокотемпературную — ионизация около 100% и температурой в 100 млн градусов (именно в таком состоянии находится плазма в звездах). Низкотемпературная плазма в привычных нам лампах дневного света широко применяется в быту. Высокотемпературная плазма используется в реакциях термоядерного синтеза и ученые не теряют надежду использовать ее в качестве замены атомной энергии, однако контроль в этих реакциях очень сложен. А неконтролируемая термоядерная реакция зарекомендовала себя как оружие колоссальной мощности, когда 12 августа 1953 года СССР испытал термоядерную бомбу.
Проверьте себя, решите тест:
1. Что не относится к агрегатным состояниям:
A. жидкость
B. газ
C. свет
2. Вязкость ньютоновских жидкостей подчиняется:
A. закону Бойля-Мариотта
B. закону Архимеда
C. закону вязкости Ньютона
3. Почему атмосфера Земли не улетает в открытый космос:
A. потому что молекулы газа не могут развить вторую космическую скорость
B. потому что на молекулы газа воздействует сила земного притяжения
C. оба ответа правильные
4. Что не относится к аморфным веществам:
A. сургуч
B. стекло
C. железо
5. При охлаждении объем увеличивается у:
A. янтаря
B. льда
C. сахара
Ответы:
1 | 2 | 3 | 4 | 5 |
C | C | B | C | B |
Вопросы для самостоятельной работы:
1. Какой тип кристаллической решетки у следующих широко используемых в быту веществ:
вода, уксусная кислота (CH3COOH), сахар (C12H22O11), калийное удобрение (KCl), речной песок (SiO2, температура плавления 1710 °C), аммиак, поваренная соль? По каким свойствам вещества можно определить тип его кристаллической решетки?
2. Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решетка
1) атомная; 2) молекулярная; 3) ионная; 4) металлическая
3. Ионную кристаллическую решетку в твердом состоянии имеет каждое из двух веществ
1) HBr и HCOONa; 2) SO3 и KNO3; 3) NaOH и Fe; 4) Ba(NO3)2 и Li2O
4. Укажите тип кристаллической решетки веществ, для которых характерны следующие свойства: ковкость, пластичность, электропроводность.
ГРУППА 308(продолжение - 2-й урок , начало )
Тема урока: Качественное определение углерода, водорода и хлора в органических веществах.
Практическая работа № 1
Качественное определение углерода, водорода и хлора в органических веществах.
Цель: научиться осуществлять качественный анализ органических веществ, совершенствовать навыки работ с лабораторным оборудованием.
Оборудование: лабораторный штатив, пробирки, пробка с газоотводной пробкой, спиртовая горелка.
Реактивы: CuO, C23H48 (парафин), CuSO4 безводный, Ca(OH)2, CCl4, медная проволока.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Смесь парафина и CuO поместили в пробирку. Безводный CuSO4 внесли ближе к отверстию. Закрепили пробирку с содержимым в горизонтальном положении. Пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили во вторую пробирку с Са(ОН)2. Содержимое первой пробирки нагрели.
Парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород - в воду:
С23Н48+70СuO→23CO2↑+24H2O+70Cu.
Выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды, вследствие образования нерастворимого карбоната кальция:
CO2+Ca(OH)2→CaCO3↓+H2O.
Безводный сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат:
CuSO4+5H2O→ CuSO4*5H2O.
По продуктам окисления парафина CO2 и H2O установили, что в его состав входит углерод и водород.
2.
Качественное определение хлора в молекулах галогенпроизводных углеводоровов.
Конец медной проволоки согнули в виде спирали и прокалили в пламени горелки до исчезновения окраски пламени. Затем охладили спираль и нанесли на нее каплю тетрахлорметана и снова внесли в пламя.

Пламя окрашивается в изумрудно-зеленый цвет.
Данная реакция является качественной для определения хлора в органических соединениях. Следовательно, в исходном веществе содержится хлор.
Общий вывод: на данной практической работе мы научились осуществлять качественный анализ органических веществ, а именно, химическим путем определили углерод и водород в предельных углеводородах и хлор в молекулах галогенпроизводных углеводоровов. А также усовершенствовали навыки работ с лабораторным оборудованием.
Задание:
I вариант
Относительная плотность паров дихлоралкана по водороду равна 49,5. Установите формулу дихлоралкана.
Решение:
D(H2)=49,5
CnH2nCl2
М (CnH2nCl2)= D(H2) · М (H2) = 49,5 · 2 = 99 г/моль
М (CnH2nCl2) = 12n + 2n + 2 · 35,5= 99 г/моль
14n=28
n=2
C2H4Cl2 искомый дихлоралкан
II вариант
Один из бромалканов содержит 65,04% брома. Установите молекулярную формулу этого вещества.
Решение:
ω(Br)=65,04%
CnH2n+1Br-?
М (CnH2n+1Br) = 12n + 2n + 1 + 80 = 123 г/моль
14n=42
n=3
C3H7Br искомый бромалкан
ГРУППА 301
Тема урока:
|
Массовая
доля растворенного вещества. |
Существуют различные способы выражения концентрации растворённого вещества в растворе, мы познакомимся с массовой долей растворённого вещества (процентной концентрацией).
I. Массовая доля растворённого вещества wрастворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора :
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!
Пример решения задачи:
Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
Дано: m раствора = 300 г wрастворённого вещества = 5% | Решение: 1. Запишем формулу для расчёта массовой доли: 2. Преобразуем формулу и вычислим массу растворённого вещества в растворе m растворённого вещества = (wрастворённого вещества · m раствора) / 100% m растворённого вещества = (5 % · 300 г) / 100% = 15 г 3. Вычислим массу растворителя – воды: m раствора = m растворённого вещества + m (H2O) m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г = 285 г Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
|
Найти: m (H2O) = ? m растворённого вещества = ? |
«Вычисление массовой доли растворённого вещества»
Задача: Сахар массой 12,5г растворили в 112,5г воды.
Определите массовую долю сахара в полученном растворе.
Дано: m сахара = 12,5 г m (H2O) = 112,5 г | Решение: 1. Запишем формулу для расчёта массовой доли: 2. Вычислим массу раствора: m раствора = m растворённого вещества + m (H2O) m раствора = 12,5 г + 112,5 г = 125 г 2. Вычислим массовую долю сахара: w% = (12,5 г · 100%) / 125 г = 10 % или 0,1 Ответ: w% = 10 %
|
ТРЕНАЖЁРЫ
Тренажёр №1 "Массовая доля"
Тренажёр №2 "Массовая и объёмная доля компонентов в смеси"
ГРУППА 108
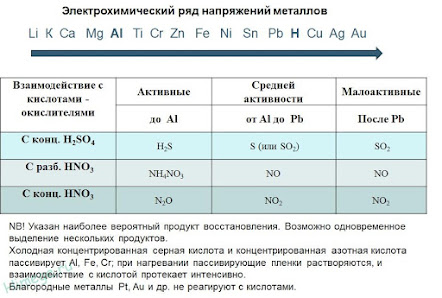
Тема урока: Общая характеристика металлов.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4






Комментариев нет:
Отправить комментарий