ПОНЕДЕЛЬНИК, 17.01.22 г. 403, 405, 308 ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время;- разборчиво и правильно выполнить работу.Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 403 ХИМИЯ 40,41
ТЕМА: Разложение нерастворимых в воде оснований. Основные способы получения оснований.
Способы получения оснований1. Щёлочи получают взаимодействием металлов и их оксидов с водой:
2. Основания получают электролизом соответствующих солей. Электролиз раствора NaCl:
3. Нерастворимые основания получают действием щёлочи на соответствующие соли:
Амфотерные гидроксиды занимают промежуточное положение между основаниями и кислотами, так как проявляют и кислотные, и основные свойства. Амфотерные гидроксиды — вещества, которые при диссоциации образуют одновременно катионы водорода — Н+ (т. е. проявляют кислотные свойства) и гидроксид-ионы — ОН- (т. е. проявляют основные свойства). Диссоциация, как основания: Диссоциация, как кислоты:
Примерами таких гидроксидов являются А1(ОН)3 — гидроксид алюминия, Zn(OH)2 — гидроксид цинка, РЬ(ОН)2 — гидроксид свинца (II), Fe(OH)3 — гидроксид железа (III), Ве(ОН)2 — гидроксид бериллия и другие. Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами оснований с образованием солей: ВОПРОСЫ И УПРАЖНЕНИЯ
ТЕСТЫ
|
Просмотрите опыт
Получение нерастворимых оснований (запишите реакции, )
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
ТЕМА: Соли и их свойства. Взаимодействие солей с металлами. Взаимодействие солей друг с другом.
Соли - это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+, гидроксилированных групп Ме(ОН)nm+) и одного (нескольких) кислотных остатков. Общая формула солей МеnАm, где А - кислотный остаток. Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица - Классификация солей по составу
| СОЛИ | |||||
Средние (нормальные) - продукт полного замещения атомов водорода в кислоте на металл AlCl3 | Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 | Основные (гидроксосоли) -продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl | Двойные - содержат два разных металла и один кислотный остаток КNaSO4 | Смешанные - содержат один металл и несколько кислотных остатков CaClBr | Комплексные [Cu(NH3)4]SO4 |
Физические свойства. Соли - это кристаллические вещества разных цветов и разной растворимости в воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+ + Cl –+ Br–.
КHSO4 К+ + НSO4– HSO4–
H+ + SO42–.
FeOHClFeOH+ + Cl– FeOH+
Fe2+ + OH–.
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+
Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O
AlOH2+ + H+
3) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 СаO + СО2.
Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32– ® CO2 + H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 Cu2+ + 2OH– ® Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
2Na + Cl2 ® 2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3
ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O + 2HNO3 ® 2NaNO3 + H2O ZnO + H2SO4 ® ZnSO4 + H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH– + ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2 + H2SO4 ® CaSO4¯ + 2H2O Zn(OH)2 + H2SO4 ® ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
ГРУППА 405 ХИМИЯ 8,9
ТЕМА:Периодический закон Д.И. Менделеева. Открытие Д.И. Менделеевым Периодического закона. Периодический закон в формулировке Д.И. Менделеева.
ВНИМАТЕЛЬНО ПРОСМОТРИТЕ ВИДЕО И СОСТАВЬТЕ ПЛАН(КРАТКО). СМОТРИТЕ, СЛУШАЙТЕ, СТАВЬТЕ НА ПАУЗУ И ЗАПИСЫВАЙТЕ.
ТЕМА: Периодическая таблица химических элементов – графическое отображение периодического закона. Структура периодической таблицы: периоды (малые и большие), группы (главная и побочная).




- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
ГРУППА 308 ХИМИЯ 39,40
ТЕМА: . Химия и здоровье человека. Лекарства. Проблемы, связанные с применением лекарственных препаратов.
Перечень вопросов, рассматриваемых в теме: урок посвящён знакомству с фармакологической химией. Учащиеся узнают химические формулы самых распространённых лекарств, их назначение и противопоказания, научатся пользоваться инструкцией к лекарственным препаратам.
Глоссарий
Амоксициллин – антибиотик широкого спектра действия группы пенициллинов, оказывает сильное противовоспалительное действие.
Аспирин – ацетилсалициловая кислота, лекарственный препарат, оказывающий жаропонижающее, противовоспалительное и обезболивающее действие.
Анафилактический шок – быстро развивающаяся аллергическая реакция при попадании в организм аллергена, без оказания своевременной медицинской помощи может закончиться летальным исходом.
Интерферон – иммуномодулирующий лекарственный препарат, оказывает противовирусный эффект.
Парацетамол – параацетиламинофенол, лекарственное средство, оказывающее жаропонижающее и обезболивающее действие.
Фармакологическая (фармацевтическая) химия – наука о лекарственных препаратах, методах их синтеза, качественного и количественного анализа, о химических свойствах лекарств и их превращениях в организме.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
История развития фармакологической химии
Человек с древних времён для лечения использовал природные средства: отвары и настои трав, мёд, животный жир. Целенаправленным созданием лекарственных препаратов впервые занялись алхимики. В XVI веке сначала арабские алхимики, позже – европейские, пытались создать эликсир бессмертия. Родоначальником ятрохимии – направления химии, занимавшейся создание лекарственных средств, считается швейцарский врач Парацельс.
Задачи фармакологической химии
В настоящее время фармакологическая (фармацевтическая) химия занимается не только созданием лекарственных препаратов, но и проводит их качественный и количественный анализ, проверяет подлинность лекарственных средств, степень их очистки от примесей, изучает превращения препаратов в организме.
Аспирин
Синтез ацетилсалициловой кислоты, известной нам как аспирин, был выполнен впервые французским химиком Шарлем Фредериком Жераром в 1853 году. В 1899 году немецкий химик Феликс Хоффманн, работавший в лаборатории фирмы «Bayer» запатентовал лечебный препарат на основе ацетилсалициловой кислоты, которой получил название «аспирин».
Аспирин применяют как жаропонижающее, противовоспалительное и обезболивающее средство. В малых дозах приём аспирина снижает риск сердечно-сосудистых заболеваний. Являясь слабой органической кислотой, аспирин снижает рН крови, разжижает её, снижая риск образования тромбов. Но любой лекарственный препарат кроме лечебного действия имеет побочные эффекты. Например, аспирин может вызывать желудочное кровотечение, так как кислота раздражает слизистую оболочку желудка.
Парацетамол
Другое популярное лекарство – парацетамол (эффералган, калпол). Название происходит от сокращения названия действующего вещества препарата – параацетиламинофенола. Парацетамол входит в состав многих комбинированных препаратов. Обладает жаропонижающим и обезболивающим эффектом. Побочные эффекты при бесконтрольном приёме парацетамола – нарушение функций печени и почек, анемия, аллергические реакции.
Пенициллин и его производные
Эпоха антибиотиков – мощных препаратов антибактериального действия началась с момента открытия в 1928 году Александром Флемнигом пенициллина. В настоящее время синтезировано большое число лекарственных препаратов на основе пенициллина. Один из них – амоксицилллин (аугментин, флемоксин), эффективный при лечении инфекционных заболеваний органов дыхания, желудочно-кишечного тракта, мочеполовой системы, кожи. Любые антибиотики следует принимать только по назначению врача и в строго указанной дозировке. Дело в том, что антибиотики уничтожают не только болезнетворные бактерии, но и полезную микрофлору кишечника. Происходит нарушение функции печени, почек, нервной системы, развивается гемолитическая анемия. В аптеках антибиотики продают только по рецепту врача. Часто на антибиотики возникает аллергическая реакция. Самое тяжёлое проявление аллергии – анафилактический шок, когда в ответ на попадание в организм аллергена быстро падает артериальное давление, происходит угнетение сознания, могут возникнуть судороги. Если вовремя не оказать медицинскую помощь при возникновении анафилактического шока, может наступить летальный исход.
Интерферон
Антибиотики эффективны при борьбе с болезнетворными бактериями, но абсолютно бесполезны и даже вредны при лечении вирусных заболеваний, таких как грипп. Для лечения вирусных заболеваний используют лекарственные препараты, усиливающие иммунитет человека. Одним из таких препаратов является интерферон (альфаферон, вэллферон). Интерферон – препарат белковой природы, выделяют из донорной крови. При его применении может возникнуть аллергия на чужеродный белок. Интерферон нельзя применять человеку, недавно перенесшему инфаркт миокарда, страдающему эпилепсией. Не рекомендуется применение интерферона беременным и кормящим женщинам, а также детям в возрасте до одного года.
Активированный уголь
Доступным и эффективным препаратом, назначаемым при отравлениях, кишечных инфекциях является активированный уголь. Это вещество является отличным сорбентом, то есть поглощает токсичные вещества, которые попали в кишечник. Активированный уголь является антацидом, то есть снижает кислотность. Но при одновременном приёме активированного угля с другими лекарственными препаратами он снижает их эффективность.
«Всё есть яд и всё есть лекарство»
Как Вы уже поняли, не существует абсолютно безопасных лекарств. Принимать лекарства следует только по назначению врача, предварительно внимательно изучив инструкцию к лекарственному препарату.
Среди синтезированных лекарственных препаратов есть и такие, которые вызывают привыкание. Это может привести к возникновению тяжёлого заболевания – наркомании. Некоторые вещества даже при однократном приеме вызывают болезненную зависимость. К серьёзным необратимым нарушениям в работе организма приводит и частое употребление алкоголя, развивается болезнь – алкоголизм. Лечение наркомании и алкоголизма – длительный процесс, здесь недостаточно профессиональных знаний врача, необходимо желание выздороветь и сильная воля самого больного.
Если вы хотите посвятить свою жизнь поиску средств спасения человека от смертельных заболеваний, то должны хорошо знать химию, чтобы продолжить обучение по специальности «Фармацевтика».
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчет максимально допустимого количества лекарственного препарата
Условие задачи: Массовая доля парацетамола в одной таблетке аскофена массой 0,50 г составляет 40%. Максимальная разовая доза парацетамола для взрослого человека составляет 1 г. Какое максимальное количество таблеток аскофена можно принять взрослому, чтобы не допустить передозировки?
Шаг первый: найдем, какая масса парацетамола содержится в одной таблетке аскофена. Для этого составим пропорцию:
0,5 г составляет 100 %, а х г составляет 40 %.
х = (0,5·40) : 100 = 0,2 (г).
Шаг второй: найдём количество таблеток, в которых в сумме будет 1 г парацетамола.
1 : 0,2 = 5 (таблеток)
Ответ: 5.
2. Расчёт необходимого количества упаковок лекарства
Условие задачи: при назначении амоксициллина детям врач исходит из допустимой дозировки 65 мг на каждые 10 кг массы тела при однократном приёме. Для поддержания постоянной концентрации препарата в крови интервал между приёмами лекарственного средства должен составлять 8 часов. Сколько упаковок лекарственного препарата по 10 таблеток, содержащих каждая 250 мг амоксициллина, необходимо для лечения ребёнка массой 40 кг, если предполагается приём таблеток в течение 5 дней?
Шаг первый: найдём дозировку для однократного приёма амоксициллина ребёнком с массой тела 40 кг.
(65 : 10)·40= 260 мг.
Эта дозировка соответствует 1 таблетке на разовый приём.
Шаг второй: найдём, сколько таблеток в день должен принимать ребёнок, если интервал между приёмами лекарства составляет 8 часов.
В сутках 24 часа. 24 : 8 = 3.
Таблетки следует принимать три раза в день.
Шаг третий: найдём общее количество таблеток, которое необходимо для курса лечения.
3·5·1 = 15 (таблеток).
Шаг четвёртый: Одна упаковка содержит 10 таблеток, то есть 15 : 10 = 1,5. Но упаковки продаются только целиком, то есть требуется купить на курс лечения 2 упаковки амоксициллина.
Ответ: 2 упаковки.
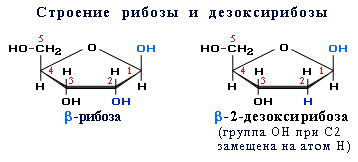
ТЕМА:Понятие об азотсодержащих гетероциклических соединениях. Пиридин. Пиррол. Пиримидиновые и пуриновые основания. Нуклеиновые кислоты: состав, строение.
Нуклеотидные звенья макромолекул ДНК могут содержать аденин, гуанин, цитозин итимин. Состав РНК отличается тем, что вместо тимина присутствует урацил.
Материал хромосом – хроматин – содержит, кроме самой ДНК, также гистоны, негистоновые белки, небольшое количество РНК. Нуклеосомный кор содержит октамер гистонов (2 х (Н2а+Н2b+H3+H4)). ГИСТОН – простой белок (примерно 50 % хроматина). Нуклеосомный кор образуется при оборачивании октамера гистонов двунитевой спирализованной ДНК на 1,5 оборота, отдельно включается дополнительный белок – гистон Н1. Все вместе носит название Хроматосом. Н1 очень богат ЛИЗ; Н2а, Н2b – умеренное количество ЛИЗ; Н3 – есть ЦИС, умеренно – АРГ; Н4 – богат АРГ и ГЛИ. |



















Комментариев нет:
Отправить комментарий