ПОНЕДЕЛЬНИК, 23.05.22 г. 403, 405, 408, 401
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ .
ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя.
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения отличной оценки обучающийся должен:- соблюдать отведенное время;- разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 БИОЛОГИЯ 50
ТЕМА:Круговорот химических элементов. Биогеохимические процессы в биосфере.
Потоки переноса вещества и энергии (в том числе и с непосредственным участием живых организмов) могут связывать не только соседние биогеоценозы, но и охватывать всю поверхность Земли.
Поэтому можно говорить о единой, сложной и взаимосвязанной экосистеме высшего ранга — биосфере.
Биосфера — это сложная, грандиозная экологогеографическая система, включающая в себя многочисленные системы низших рангов: биогеоценозы, популяции, организмы. Все они определенным образом взаимодействуют друг с другом и обеспечивают, с одной стороны, определенную устойчивость биосферы, а с другой — ее развитие, эволюцию. Во многом и то и другое определяется биологическим разнообразием, т. е. тем многообразием форм жизни и биологических систем, какое мы можем реально наблюдать ныне и реконструируем для прошлых эпох.
Современное представление о биосфере как уникальной саморегулируемой, самовоспроизводимой и самоорганизующейся системе восходит к работам французского философа и палеонтолога Пьера Тейяра де Шардена и русского ученого Владимира Ивановича Вернадского начала XX в. Английский исследователь Джеймс Лавлок, развивая их взгляды, образно описывает биосферу как своеобразный сверхорганизм — Гею.
Биосфера в современном ее понимании — это оболочка Земли, охваченная деятельностью живого, в том числе и те части планеты, которые непосредственно зависят или зависели от нее в прошлом.
Верхняя граница биосферы соответствует озоновому слою стратосферы, т. е. располагается на высоте около 22-25 км. Нижняя проходит в основном по нижним горизонтам отложений осадочных пород, т. е. на глубине 5-7 км (рис. 36).
Та часть биосферы, где сейчас живые существа встречаются постоянно называют эубиосферой. Ее мощность существенно меньше — 5—6 км над поверхностью Земли и менее километра под ее поверхностью (если не принимать во внимание данные последних десятилетий XX в.
В каждой точке земной поверхности складываются уникальные условия, нигде больше точно не повторяющиеся. Именно поэтому разнообразие сообществ почти неисчерпаемо. Однако в биосфере можно выделить основные их типы — биомы, существование которых во многом определяется общими физико-географическими условиями. Большинство биомов имеют свои народные названия — тайга, степь, пустыня и т. д.
Биомы различаются не только по видовому составу организмов, но и по биомассе, продукции, по скорости сукцессионных процессов (см. таблицу).
Можно выделить несколько основных групп биомов.
Лесные биомы существуют в условиях хорошего увлажнения и достаточной теплообеспеченности. Для них характерно господство деревьев и связанных с ними животных. Их биомасса много больше годовой продукции. Темпы сукцессий можно оценить как средние.
При недостаточном увлажнении, но сравнительно хорошей обеспеченности теплом формируются травянистые биомы — степи, прерии, саванны и т.п. Здесь господствуют травы, а деревья и кустарники относительно редки или отсутствуют вовсе. Обильны травоядные животные — копытные, грызуны,

Необходимые для жизни элементы условно называют биогенными (дающими жизнь) элементами, или питательными веществами. Различают две группы питательных веществ:
- к макротрофным веществам относятся элементы, которые составляют химическую основу тканей живых организмов. Это углерод, водород, кислород, азот, фосфор, калий, кальций, магний, сера.
- К микротрофным относят элементы, содержание которых в живых организмах незначительное. Их часто называют микроэлементами. Это железо, марганец, медь, цинк, бор, натрий, молибден, хлор, ванадий и кобальт. Недостаток микроэлементов может оказывать сильное влияние на живые организмы (в частности, ограничивать рост растений), так же как и нехватка биогенных элементов.

В процессе фотосинтеза углекислый газ превращается растениями в органическое вещество, служащее пищей животным.
Запасы углерода в атмосфере оцениваются в


Некоторые организмы могут играть исключительно важную роль в круговороте фосфора. Моллюски, например, фильтруя воду и извлекая оттуда мелкие организмы, их остатки, захватывают и удерживают большое количество фосфора. Несмотря на то что роль моллюсков в пищевых цепях прибрежных морских сообществ невелика (они не образуют плотных скоплений с высокой биомассой, их пищевая ценность невысока), эти организмы имеют первостепенное значение как фактор, позволяющий сохранить плодородие той зоны моря, где они обитают. Популяции моллюсков подобны природным аккумуляторам, только вместо электроэнергии они накапливают и удерживают фосфор, необходимый для поддержания жизни в прибрежных зонах морей. Иначе говоря, популяция этих организмов более важна для экосистемы как «посредник» в обмене веществом между живой и неживой природой (сообществом и биотопом).
Этот пример — хорошая иллюстрация того, что ценность вида в природе не всегда зависит от таких показателей, как его обилие или сырьевые качества. Эта ценность может проявляться лишь косвенно и не всегда обнаруживается при поверхностном исследовании
ГРУППА 405 ХИМИЯ 51,52
|
Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость |
На уроке проводятся эксперименты, демонстрирующие зависимость скорости химической реакции от различных факторов. Из материалов данного урока вы узнаете, как влияют на скорость химической реакции степень измельчения, концентрация и природа веществ, а также температура и наличие катализатора.
- Изучение влияния природы кислоты
В одну пробирку наливаем раствор соляной кислоты, а в другую – столько же уксусной (примерно одинаковой концентрации). Одновременно помещаем в них по грануле цинка. В обеих пробирках протекает реакция замещения с выделением водорода:
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2CH3COOH = Zn(CH3CОО)2 + H2↑
В пробирке с уксусной кислотой водород выделяется с меньшей скоростью. Это можно объяснить тем, что уксусная кислота обладает меньшими кислотными свойствами по сравнению с соляной кислотой.
- Изучение влияния природы металла
В две пробирки нальем одинаковое количество соляной кислоты и одновременно поместим в них по кусочку металлов разной природы: цинка и магния. Уравнения данных реакций:
Zn + 2HCl = ZnCl2 + H2↑
Mg + 2HCl = MgCl2 + H2↑
Реакция соляной кислоты с магнием протекает с большей скоростью, так как интенсивнее выделяется водород. Магний – более активный металл, чем цинк (магний стоит в ряду напряжений левее цинка). Рис. 1.

Рис. 1. Результаты опыта по взаимодействия цинка (слева) и магния (справа) с соляной кислотой
ОПЫТ № 2. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ПЛОЩАДИ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ
- Изучение влияния степени измельчения вещества (поверхности соприкосновения реагирующих веществ).
В две пробирки нальем примерно по 2 мл раствора медного купороса. Одновременно поместим в одну пробирку кусок железной проволоки, а в другую – железный порошок. В обеих пробирках протекает реакция замещения в соответствии с уравнением:
Fe + CuSO4 = FeSO4 + Cu↓
О протекании реакции замещения между сульфатом меди (II) и железом можно судить по выделению из раствора вещества красно-бурого цвета – меди. Признаки реакции быстрее появились в пробирке с порошком железа, т. к. порошок железа имеет большую площадь поверхности соприкосновения с раствором медного купороса. Мы видим, что измельчение вещества приводит к повышению скорости реакции.

Рис. 2. Результаты опыта по взаимодействия железного гвоздя и железного порошка с раствором CuSO4
ОПЫТ № 3. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ИСХОДНЫХ ВЕЩЕСТВ
В две пробирки поместим по 2 гранулы цинка и осторожно прильем растворы уксусной кислоты: в первую пробирку – 9%-ный уксус, а во вторую – 70%-ную кислоту. Реакция протекает быстрее в той пробирке, в которой больше концентрация уксусной кислоты.
ОПЫТ № 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
В две пробирки с соляной кислотой одинаковой концентрации добавим по 1 грануле цинка. Одну из пробирок поместим в стакан с горячей водой. Наблюдаем, что при нагревании скорость выделения водорода увеличивается. Скорость реакции зависит от температуры, при которой она проводится.
ОПЫТ № 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ УЧАСТИЯ КАТАЛИЗАТОРА
На дно стакана нальем 3%-ный раствор перекиси водорода. Пероксид водорода – очень непрочное вещество и легко разлагается на воду и кислород:
2H2O2 = 2H2O + O2↑.
При обычных условиях реакция разложения пероксида водорода протекает медленно, признаков реакции (т. е. выделения пузырьков газа) мы не наблюдаем. Добавим в стакан с перекисью водорода немного черного порошка оксида марганца (IV). Наблюдаем интенсивное выделение пузырьков газа. Внесем в стакан тлеющую лучинку – она разгорается, следовательно, выделяющийся газ – кислород. Почему при внесении в стакан оксида марганца скорость реакции увеличилась? Дело в том, что оксид марганца является катализатором реакции разложения пероксида водорода. Катализатор, участвуя в реакции, ускоряет ее, но сам в ней не расходуется.

Рис. 3. Разложение пероксида водорода под действием катализатора MnO2
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Решение:
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
Решение:
По правилу Вант-Гоффа
υ=υ0·γ (t2-t1)/10
По условию задачи требуется определить υ/υ0:
υ/υ0=2 (70-30)/10 = 24 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O2 (г) = SO2 (г)
Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
Решение:
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к1 C (O2)
υ = к2 C2(SO2)·C (O2)
Задача №4
Как изменится скорость реакции:
S (тв) + O2 (г) = SO2 (г)
при увеличении давления в системе в 4 раза?
Решение:
- Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О2) = а, концентрация серы - твёрдого вещества не учитывается.
υ = к1 а
- При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
υ' = к1 4а
- Определяем, во сколько раз возрастёт скорость реакции:
Задача №5
Как изменится скорость реакции:
2SО2 (г) + O2 (г) = 2SO3 (г)
при увеличении давления в системе в 2 раза?
Решение:
- Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO2
С(SО2) = а, концентрация кислорода C(O2) = b.
υ = к1 а2·b
- При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ' = к1 (2а)2·2b = к14а2·2b= к18а2·b
- Определяем, во сколько раз возрастёт скорость реакции:
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
Дано: t0= 10 ºС t= 20ºС τ0= 300c τ= 60c |
γ=? |
Решение:
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ0=∆C/∆τ0,
υ0=∆C/300, ∆C= 300υ0
При температуре 30 ºС скорость реакции равна υ=∆C/∆τ,
υ=∆C/60, ∆C= 60υ. Следовательно, 300υ0=60υ, а υ/υ0=300/60=5.
2) По правилу Вант Гоффа: υ= υ0γ∆t/10, υ/υ0= γ∆t/10
3) Согласно рассуждениям (1) и (2), получим γ(20-10)/10= γ=5
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов: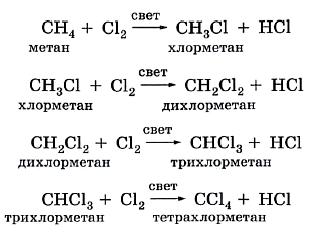
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:![]()
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования. |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речьПОЗЖЕ .
Тема: Применение алканов на основе свойств.
Области применения алканов связаны с их физико-химическими свойствами:
Таблица «Предельные углеводороды
(алканы, парафины)»

ГРУППА 408 ХИМИЯ 55
ТЕМА: Свойства альдегидов.
ХИМИЧЕСКИЕ СВОЙСТВА
Карбонильные соединения — реакционно-способные вещества.
Присоединение
Присоединение водорода — общее свойство альдегидов и кетонов, обусловленное карбонильной группой.
Карбонильные соединения восстанавливаются водородом в спирты!
Другие реакции присоединения
Активность альдегидов и кетонов в реакциях присоединения (особенно полярных молекул веществ) определяется величиной частичного положительного заряда на атоме углерода карбонильной группы.
Легкость протекания таких реакций увеличивается в ряду:
кетоны < альдегиды < формальдегид.
Алкильные радикалы уменьшают частичный заряд δ+ на реакционном центре. Самым активным из карбонильных соединений является формальдегид, молекула которого не содержит алкильных радикалов.
Присоединение полярных молекул карбонильными соединениями:
В такой гидратной форме и существует преимущественно формальдегид в водном растворе.
Образующийся продукт содержит на один атом углерода больше, чем исходный альдегид. Такая реакция применяется для удлинения углеродной цепи в органических молекулах.
Образующиеся производные альдегидов и метилкетонов выпадают в осадок и при нагревании с минеральными кислотами разлагаются с образованием первоначальных карбонильных соединений.
Эта реакция используется для обнаружения указанных карбонильных соединений, выделения их из смеси с другими веществами, для очистки.
Из формальдегида — углевод!
Обратите внимание на очень важный в развитии органической химии синтез. В 1861 г. А.М. Бутлеров обнаружил способность формальдегида под влиянием гидроксида кальция образовывать линейные карбоцепные полимеры, близкие по свойствам к сахаристым веществам.
Окисление
Качественные реакции на альдегиды, обусловленные разрывом связи
1. Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»):
Реакция «серебряного зеркала»
• В колбу с аммиачным раствором оксида серебра добавляем по стенке разбавленный водой формалин.
• Помещаем колбу в стакан с горячей водой.
• На стенках колбы образуется осадок серебра — красивый зеркальный налет.
2. Окисление свежеприготовленным гидроксидом меди (II):
Окисление формальдегида гидроксидом меди (II)
• В пробирку наливаем 1 мл формалина, добавляем к нему равный объем раствора гидроксида натрия, а затем несколько капель раствора сульфата меди (II).
• Полученную смесь осторожно нагреваем на спиртовке.
• Наблюдаем постепенное изменение окраски с образованием в итоге красного осадка.
Как с помощью свежеприготовленного гидроксида меди (II) Сu(OH)2 доказать, что из двух растворов один раствор многоатомного спирта (например, глицерин), другой — раствор альдегида (например, формалин)?
ОтветГлицерин + Сu(OH)2 ярко-синий раствор
Формалин + Сu(OH)2 смесь осадок красного цвета Cu2O↓
Полимеризацией формальдегида получают полиформальдегид (–CH2–O–)n.
При взаимодействии формальдегида с фенолом образуется фенолоформальдегидная смола .
Изделия из фенолоформальдегидной смолы
Дополнительная информация
Полимеризация формальдегида
Поликонденсация формальдегида с фенолом — реакция образования полимера с выделением побочного низкомолекулярного продукта.
Схема процесса, протекающего в кислотной или щелочной среде:
При достаточном количестве реагентов реакция продолжается с участием всех «подвижных» атомов водорода и получением пространственного полимера, имеющего уникальные свойства (твердость, устойчивость к нагреванию, высокие диэлектрические характеристики).
Это интересно!
Муравьи для подачи сигнала тревоги выделяют два феромона: непредельный альдегид
Это интересно!
Одним из пользующихся большим спросом и дорогих пахучих веществ является мускус. Его извлекают из железы самца мускусной кабарги. Самец кабарги этим запахом привлекает самку. Непосредственный носитель запаха — мускон (I) — составляет в мускусе только около 1%. Аналогичные соотношения у еще одного пахучего природного продукта — цибета, получаемого от самцов и самок африканской цибетовой кошки. Носитель запаха — цибетон (II). Мускон и цибетон — кетоны:


















Комментариев нет:
Отправить комментарий