ВТОРНИК 24/05/22 405,408,305
ГРУППА 405, ХИМИЯ, 53
ТЕМА: Химическое равновесие и способы его смещения.
ПОНЯТИЕ ПРЯМОЙ И ОБРАТНОЙ РЕАКЦИИ
Рассмотрим некоторую абстрактную реакцию, которую запишем в виде:
А+В→АВ, Прямая реакция. Но многие химические реакции могут идти в обратную сторону.
АВ ![]() А+В; Обратная реакция.
А+В; Обратная реакция.
Для краткости такую реакцию записывают, используя две стрелки, одну – вперед, другую – назад.
А+В![]() АВ
АВ
При повышении температуры скорость большинства химических реакций увеличивается. Но оказывается, что в случае некоторых реакций продукт реакции при температуре, когда она идет с хорошей скоростью, уже начинает разлагаться. В частности, такая ситуация реализуется при взаимодействии водорода с йодом при получении йодоводорода.
Н2 + I2![]() (1)
(1)
Скорость химической реакции увеличивается с увеличением концентрации исходных веществ и соответственно уменьшается с уменьшением концентрации исходных веществ. Получается, что, по мере прохождения реакций, скорость прямой реакции будет уменьшаться, т. к. исходные вещества будут расходоваться. А скорость обратной реакции будет возрастать, потому что концентрация вещества АВ исходного для обратной реакции будет постепенно увеличиваться. До каких пор скорость прямой реакции будет уменьшаться, а обратной увеличиваться? Это будет до того момента, когда скорости прямой и обратной реакции станут равными. Наступит химическое равновесие. Рис. 1.

Рис. 1
Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны.
КОНСТАНТА РАВНОВЕСИЯ
Равновесная концентрация веществ
Равновесная концентрация веществ – это концентрации веществ в реакционной смеси, находящихся в состоянии химического равновесия. Равновесная концентрация обозначается химической формулой вещества, заключенной в квадратные скобки.
Например, следующая запись![]() обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.
обозначает, что равновесная концентрация водорода в равновесной системе составляет 1 моль/л.

Рис. 2
Химическое равновесие (Рис. 2) отличается от привычного для нас понятия «равновесие». Химическое равновесие – динамическое. В системе, находящейся в состоянии химического равновесия, происходят и прямая, и обратная реакции, но их скорости равны, и поэтому концентрации участвующих веществ не меняются. Химическое равновесие характеризуется константой равновесия, равной отношению констант скоростей прямой и обратной реакций.
![]()
Константы скорости прямой и обратной реакции – это скорости данной реакции при концентрациях исходных для каждой из них веществ в равных единицах. Также константа равновесия равна отношению равновесных концентраций продуктов прямой реакции в степенях стехиометрических коэффициентов к произведению равновесных концентраций реагентов.
![]()
Если ![]() , то в системе больше исходных веществ. Если
, то в системе больше исходных веществ. Если ![]() , то в системе больше продуктов реакции.
, то в системе больше продуктов реакции.
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Если константа равновесия значительно больше 1, такую реакцию называют необратимой.
Необратимыми называются химические реакции, которые происходят только в одном направлении до полного расходования одного из реагентов.
Например, это реакция:
4Р+5О2 =2Р2О5 (2)
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ
Если изменить внешние условия, то состояние химического равновесия нарушится. Смещение равновесия в зависимости от изменения внешних условий в общем виде определяется
· Принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении.
Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. Какие факторы можно изменять, чтобы сместить равновесие? Это
· Температура
· Давление
· Концентрации веществ
· Добавление катализатора
· Изменение площади реакционной поверхности гетерогенных реакций
Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия.

Остальные факторы рассматриваем более детально.
Температура
Реакция синтеза аммиака (Рис. 3)
относится к экзотермическим реакциям. При прохождении прямой реакции теплота выделяется, а при прохождении обратной – поглощается. Если увеличить температуру, то, согласно правилу Ле Шателье, равновесие сместится в таком направлении, чтобы уменьшить это воздействие. В данном случае влево, так как теплота поглощается. Реакция синтеза аммиака проводится при температуре около 500![]()
Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо.
Изменение концентрации веществ
При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Например, при увеличении концентрации азота в реакции синтеза аммиака, равновесие сместится вправо, т. е. в сторону расходования азота. Если же в этой реакции удалять из реакционной смеси аммиак, то равновесие сместится в сторону его образования. Сделать это можно, например, при растворении аммиака в воде.
Изменение давления
Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака.
Если число моль газа одинаково и слева и справа, например, в реакции получения оксида азота (II),
N2 +O2![]() (3)
(3)
то изменение давления не будет оказывать влияние на положение химического равновесия в таких реакциях. Изучение химического равновесия имеет большое значение, как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Окончательный выбор условий требует учета влияния их и на скорость процесса.
Подведение итога урока
На уроке была изучена тема «Химическое равновесие», рассмотрены условия смещения равновесия в случае обратимых реакций.
ГРУППА 408 ХИМИЯ, 56
ТЕМА: Альдегиды. Получение и применение.
ПОСМОТРИТЕ ВИДЕО, СОСТАВЬЕ ПЛАН.ГРУППА 305 ХИМИЯ, 40,41,42,43
ТЕМА 40 : Применение жиров на основе свойств.
- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка.
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
ТЕМА 41:Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Крахмал по химическим свойствам является многоатомным спиртом, который может образовывать простые и сложные эфиры.
Характерная качественная реакция на крахмал - йодкрахмальная реакция. При помощи крахмала обнаруживается молекулярный йод I2.
Для проведения опыта приготавливается водный раствор крахмала – клейстер. В раствор капается капля йода, и клейстер в месте соприкосновения темно-коричневого йода приобретает насыщенный темно-синий цвет – это универсальная качественная реакция на йод.
Йод не взаимодействует с крахмалом с образованием валентных или ионных связей. Качественная реакция крахмала основывается на слабых межмолекулярных взаимодействиях.
.
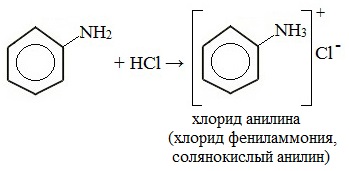
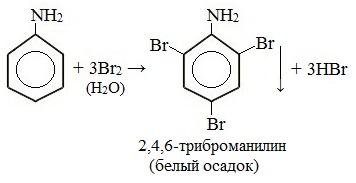
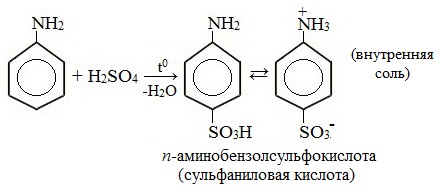
Определение Амины – класс органических соединений, производные аммиака (NH3 СТРОЕНИЕ И КЛАССИФИКАЦИЯ АМИНОВПоскольку амины являются продуктами замещения водорода в аммиаке, то все они являются донорами электронной пары, принадлежащей атому азота, то есть проявляют свойства оснований (по Льюису).
Амины классифицируют: 1. По степени замещенности атомов водорода в молекуле аммиака на
Радикалы, входящие в молекулу амина могут быть одинаковыми или разными. 2. По типу радикала выделяют амины алифатического и ароматического ряда. Типичным представителем ряда ароматических аминов является анилин
Изомерия алифатических аминовДля алифатических аминов характерна следующая изомерия:
НОМЕНКЛАТУРА АМИНОВ 1. По систематической номенклатуре амины называют путем добавления суффикса "амин" к названию углеводорода. 2. По рациональной номенклатуре их рассматривают как алкил- или ариламины.
У ароматических аминов в основе названия также лежит слово амин, кроме того такие соединения имеют тривиальные названия:
3. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы - ФИЗИЧЕСКИЕ СВОЙСТВАПервые представители ряда аминов - метиламин, диметиламин и триметиламин – газы. Остальные низшие амины – жидкости. Обладают резким характерным удушливым запахом. Канцерогены. Высшие амины – твердые вещества, без запаха. Первые представители аминов хорошо растворимы в воде. Высшие амины в воде не растворяются. Это связано с тем, что связь N–H более полярна, чем связь С–H, но менее полярна, чем связь C–O, поэтому водородные связи между молекулами аминов выражены слабее, чем, например, в молекулах спиртов. Основные представителя ряда аминовАлкиламиныМетиламин По своим химическим свойствам метиламин является типичным первичным амином, то есть подобно аммиаку, образует четвертичные соли с кислотами и реагирует с водой, образуя донорно-акцепторную связь, при взаимодействии со сложными эфирами или ацилхлоридами дает амиды (подробнее см. тему: "Производные карбоновых кислот. Амиды. Ангидриды. Хлорангидриды") Триметиламин
|












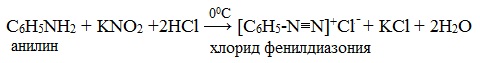
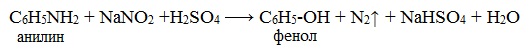
Комментариев нет:
Отправить комментарий