Здравствуйте, уважаемые студенты, записывайте дату, тему и выполняйте необходимые записи(ВСЁ подряд не пишите, читайте, выбирайте, можно составить план, ЕСЛИ ЕСТЬ ВИДЕО, НАДО ПОСМОТРЕТЬ ,ВЫПОЛНИТЬ ПО НЕМУ ЗАПИСИ, МНОГО НЕ НУЖНО ПИСАТЬ. Материала может быть выложено много, но это не значит, что всё надо записывать! После этого, сфотографируйте и отошлите мне на почту rimma.lu@gmail.com Тетрадь привезете, когда перейдем на очную форму обучения.)
Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
СПРАВА НАХОДИТСЯ АРХИВ- ТАМ СМОТРИМ ДАТУ И ГРУППЫ
РАСПИСАНИЕ ЗАНЯТИЙ НА НЕДЕЛЮ: 13.03.23г. - 17.03.23г.
Пн.13.03: 306, 401, 401, 403
Вт. 14.03:508, 505, 505, 501
Ср. 15..03: 406, 403, 401, 501
Чт. 16.03: .., 501, 306, 508
Пт. 17.03: 505, ..., 501
ГРУППА 306 БИОЛОГИЯ 69,70
ТЕМА : Биосфера и биомы.Круговорот химических элементов. Биогеохимические процессы в биосфере.
Биосфера – слово греческое и означает в переводе на наш язык : БИО - жизнь, СФЕРА – шар, т.е. биосфера – это есть сфера жизни. Впервые термин биосфера был введен в науку геологом из Австрии Э. Зюссом в 1875 г. Он понимал под биосферой тонкую пленку жизни на земной поверхности или тот слой около земного пространства, где обитают живые существа, взаимодействующие с воздухом, водой и земной корой.
Биосфера – часть оболочки Земли или это многокомпонентная, сложная, саморегулирующаяся система, структура и энергетика которой обусловлены прошлой и современной деятельностью живых организмов.
Подобно тому, как любой организм состоит из многочисленных функциональных единиц – клеток, так и биосфера слагается из функциональных единиц, клеток биосферы – экологических систем.
Экосистема – это сочетание живых организмов и окружающей среды в качестве взаимодействующей системы, которая является следствием взаимодействия растений с растением, животного с животным, растений и животных друг с другом и всех живых организмов с окружающей средой и физической среды с ними.
Экологические системы могут быть весьма многочисленными и разнообразными. Даже на сравнительно небольшой территории могут существовать экосистема леса и экосистема луга, экосистема озера и экосистема болота, переходные экосистемы почвы и грунтовых вод. И у каждой из этих систем свой набор растений, животных, микроорганизмов.
Однако существуют и очень крупные экологические системы, объединяющие большое число отдельных экосистем. Их называют биомы.
Биомами являются: леса, степи, тундра, пустыни, тропические дождевые леса. Существует также экосистема человека, которая наряду с человеком включает культурные растения и домашних животных.
Экосистемы являются совокупностью сообществ определенного видового состава, объединенных единым местом обитания. Переходы между крупными экосистемами (биомами) постепенны (например, между лесом и степью имеется переходная зона лесостепь).
Важнейшим свойством экосистемы является саморегуляция, которая обеспечивается высокой адаптацией отдельных организмов, популяций и биоценозов, наличием замкнутого круговорота веществ в пределах каждой экосистемы. Если подобный круговорот остается ненарушенным, несмотря на внешние воздействия, экосистема остается стабильной длительное время.
Для каждой экосистемы существует свой пороговый уровень внешних воздействий, при котором экосистема переходит в качественно новый уровень или гибнет. Снятие воздействия не приводит к восстановлению исходного состояния экосистемы. Она может самостоятельно восстановится эволюционным путем, либо заменится другой экосистемой. Например, погибший хвойный лес вначале замещается лиственным лесом, а затем в ходе длительной эволюции доминантными вновь становится хвойные породы. Такое свойство экосистем называется необратимостью.
Биогеоценоз (термин предложен академиком В.Н. Сукачевым в 1940г.) био – жизнь, гео –земля, ценоз – общий. Под биогеоценозом следует понимать сообщество растений (фитоценоз) и животных (зооценоз), которые обитают на соответствующем участке земной поверхности, имеющем свой микроклимат, структуру, почву и водный режим. Проще говоря – это единое сообщество растений, животных и окружающей среды, которые находятся в тесной взаимосвязи друг с другом. Биогеоценозы разнообразны и формировались они в зависимости от климата и истории участка земли. Поэтому они в различной степени насыщены жизнью. Чем разнообразнее и сложнее биогеоценоз, тем выше его устойчивость, способность противостоять различным внешним и внутренним воздействиям. Процесс формирования связей в биогеоценозах происходил последовательно и поэтапно. В результате сложились определенные закономерности изменения биогеоценозов во времени – сукцессии. Например, восстановление лесов после пожара происходит поэтапно: вначале территории занимают светолюбивые породы, а затем последовательно породы сменяются на более теневыносливые. При этом лес принимает все большую биологическую устойчивость.
Устойчивость биогеоценозов определяется тем, что виды организмов, образующие их в процессе развития приспособились друг к другу настолько, что они как бы заботятся о целостности, устойчивости, оптимальной структуре своего биогеоценоза. Например, на пастбищах максимальная продуктивность травостоя бывает не в заповедных условиях, а когда ее потребление, т.е. выпас, соответствует определенной норме.
Устойчивость биогеоценозов определяется так же тем, что составляющие биогеоценоз организмы – не простой конгломерат особей различных видов, а совокупность популяций видов, т.е. качественно определенных группировок особей, способных при изменяющихся условиях среды поддерживать свою численность в оптимальных размерах.
Агроценоз (агрозооценоз) – созданное человеком сообщество растений или животных с целью получения сельскохозяйственной продукции. Как правило, агроценоз состоит из небольшого числа растений и животных видов. Во всем мире агроценозы составляют огромные посевные площади и многочисленные стада домашних животных.
Круговорот химических элементов. Биогеохимические процессы в биосфере.Потоки переноса вещества и энергии (в том числе и с непосредственным участием живых организмов) могут связывать не только соседние биогеоценозы, но и охватывать всю поверхность Земли.
Поэтому можно говорить о единой, сложной и взаимосвязанной экосистеме высшего ранга — биосфере.
Биосфера — это сложная, грандиозная экологогеографическая система, включающая в себя многочисленные системы низших рангов: биогеоценозы, популяции, организмы. Все они определенным образом взаимодействуют друг с другом и обеспечивают, с одной стороны, определенную устойчивость биосферы, а с другой — ее развитие, эволюцию. Во многом и то и другое определяется биологическим разнообразием, т. е. тем многообразием форм жизни и биологических систем, какое мы можем реально наблюдать ныне и реконструируем для прошлых эпох.
Современное представление о биосфере как уникальной саморегулируемой, самовоспроизводимой и самоорганизующейся системе восходит к работам французского философа и палеонтолога Пьера Тейяра де Шардена и русского ученого Владимира Ивановича Вернадского начала XX в. Английский исследователь Джеймс Лавлок, развивая их взгляды, образно описывает биосферу как своеобразный сверхорганизм — Гею.
Биосфера в современном ее понимании — это оболочка Земли, охваченная деятельностью живого, в том числе и те части планеты, которые непосредственно зависят или зависели от нее в прошлом.
Верхняя граница биосферы соответствует озоновому слою стратосферы, т. е. располагается на высоте около 22-25 км. Нижняя проходит в основном по нижним горизонтам отложений осадочных пород, т. е. на глубине 5-7 км (рис. 36).
Та часть биосферы, где сейчас живые существа встречаются постоянно называют эубиосферой. Ее мощность существенно меньше — 5—6 км над поверхностью Земли и менее километра под ее поверхностью (если не принимать во внимание данные последних десятилетий XX в.
В каждой точке земной поверхности складываются уникальные условия, нигде больше точно не повторяющиеся. Именно поэтому разнообразие сообществ почти неисчерпаемо. Однако в биосфере можно выделить основные их типы — биомы, существование которых во многом определяется общими физико-географическими условиями. Большинство биомов имеют свои народные названия — тайга, степь, пустыня и т. д.
Биомы различаются не только по видовому составу организмов, но и по биомассе, продукции, по скорости сукцессионных процессов (см. таблицу).
Можно выделить несколько основных групп биомов.
Лесные биомы существуют в условиях хорошего увлажнения и достаточной теплообеспеченности. Для них характерно господство деревьев и связанных с ними животных. Их биомасса много больше годовой продукции. Темпы сукцессий можно оценить как средние.
При недостаточном увлажнении, но сравнительно хорошей обеспеченности теплом формируются травянистые биомы — степи, прерии, саванны и т.п. Здесь господствуют травы, а деревья и кустарники относительно редки или отсутствуют вовсе. Обильны травоядные животные — копытные, грызуны,

Необходимые для жизни элементы условно называют биогенными (дающими жизнь) элементами, или питательными веществами. Различают две группы питательных веществ:
- к макротрофным веществам относятся элементы, которые составляют химическую основу тканей живых организмов. Это углерод, водород, кислород, азот, фосфор, калий, кальций, магний, сера.
- К микротрофным относят элементы, содержание которых в живых организмах незначительное. Их часто называют микроэлементами. Это железо, марганец, медь, цинк, бор, натрий, молибден, хлор, ванадий и кобальт. Недостаток микроэлементов может оказывать сильное влияние на живые организмы (в частности, ограничивать рост растений), так же как и нехватка биогенных элементов.

В процессе фотосинтеза углекислый газ превращается растениями в органическое вещество, служащее пищей животным.
Запасы углерода в атмосфере оцениваются в

Некоторые организмы могут играть исключительно важную роль в круговороте фосфора. Моллюски, например, фильтруя воду и извлекая оттуда мелкие организмы, их остатки, захватывают и удерживают большое количество фосфора. Несмотря на то что роль моллюсков в пищевых цепях прибрежных морских сообществ невелика (они не образуют плотных скоплений с высокой биомассой, их пищевая ценность невысока), эти организмы имеют первостепенное значение как фактор, позволяющий сохранить плодородие той зоны моря, где они обитают. Популяции моллюсков подобны природным аккумуляторам, только вместо электроэнергии они накапливают и удерживают фосфор, необходимый для поддержания жизни в прибрежных зонах морей. Иначе говоря, популяция этих организмов более важна для экосистемы как «посредник» в обмене веществом между живой и неживой природой (сообществом и биотопом).
Этот пример — хорошая иллюстрация того, что ценность вида в природе не всегда зависит от таких показателей, как его обилие или сырьевые качества. Эта ценность может проявляться лишь косвенно и не всегда обнаруживается при поверхностном исследовании.
ГРУППА 401 ХИМИЯ 49,50,51
ТЕМА: Химические свойства белков: горение, денатурация, гидролиз, цветные реакции.
Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Изучение свойств белков. Биологические функции белков.
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
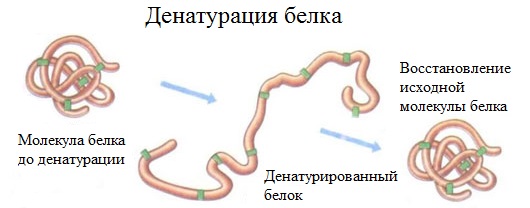
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: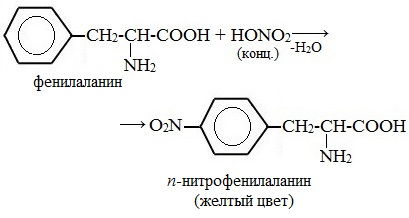
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом: 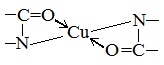
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки входят в состав каждой клетки и составляют около 50% ее сухой массы. Они играют ключевую роль в обмене веществ, реализуют важнейшие биологические функции, лежащие в основе жизнедеятельности всех организмов.
Среди большого разнообразия функций, выполняемых белками, первостепенное значение имеют структурная, или пластическая, и каталитическая. Это универсальные функции, поскольку они присущи всем живым организмам.
Структурные белки формируют каркас внутриклеточных органелл и внеклеточных структур, а также участвуют в стабилизации клеточных мембран. Такие структурные белки, как коллаген и эластин составляют основу соединительной и костной тканей высших животных и человека. Структурными белками, в частности, являются кератины кожи, волос, ногтей, шерсти, когтей, рогов, копыт, перьев, клювов, а также фиброин шелка, паутины.
Каталитически активными белками являются ферменты. Они ускоряют химические реакции, обеспечивая тем самым необходимые скорости протекания обменных процессов в клетке.
Многие белки, присущие отдельным живым организмам, выполняют специфические функции, среди которых наиболее важными являются транспортная, регуляторная, защитная, рецепторная, сократительная, запасная и некоторые др.
Транспортные белки переносят различные молекулы и ионы внутри организма. Например: гемоглобин — кислород от легких к тканям; миоглобин — кислород внутри клеток; сывороточный альбумин с током крови — жирные кислоты, а также ионы некоторых металлов. Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Регуляторные белки участвуют в регуляции обмена веществ как внутри клеток, так и в целом организме. Например, такие сложные процессы, как биосинтез белков и нуклеиновых кислот, протекают под строгим «контролем» множества регуляторных белков. Специфические белковые ингибиторы регулируют активность многих ферментов.
Защитные белки формируют защитную систему живых организмов. Например, иммуноглобулины (антитела) и интерфероны предохраняют организм от проникновения в его внутреннюю среду вирусов, бактерий, чужеродных соединений, клеток и тканей. Белки свертывающей системы крови — фибриноген, тромбин — препятствуют потере крови при повреждениях кровеносных сосудов.
Рецепторные белки воспринимают сигналы, поступающие из внешней среды, и воздействуют на внутриклеточные процессы. Например, белки-рецепторы, сосредоточенные на поверхности клеточных мембран, избирательно взаимодействуют с регуляторными молекулами (например, гормонами).
Рецепторными белками являются родопсин, участвующий в зрительном акте, вкусовой сладкочувствительный и обонятельный белки.
Сократительные белки способны преобразовывать свободную химическую энергию в механическую работу. Например, белки мышц миозин и актин обеспечивают мышечное сокращение.
Запасные белки представляют собой резервный материал, предназначенный для питания развивающихся клеток. Запасными белками являются яичный альбумин, глиадин пшеницы,
Казеин кукурузы, казеин молока и многие другие. Запасные белки — существенный источник пищевого белка для человека.
Некоторые организмы вырабатывают токсические белки. Таковы яды змей, дифтерийный токсин, рицин семян клещевины, лектины семян бобовых и др.
ГРУППА 403 ХИМИЯ 12,13 ТЕМА : Карбоновые кислоты. Понятие о карбоновых кислотах. Карбоксильная группа как функциональная. Гомологический ряд предельных однооснóвных карбоновых кислот. Получение карбоновых кислот окислением альдегидов . Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп. Изомеры и гомологи Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров
Алгоритм составления названий карбоновых кислот
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами
Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот. Химические свойства кислот Упрочнение
Получение карбоновых кислот
ТЕМА :Химические свойства уксусной кислоты: общие свойства с минеральными кислотами и реакция этерификации. Свойства уксусной кислоты, общие со свойствами минеральных кислот. Применение уксусной кислоты на основе свойств. Химические свойства карбоновых кислот Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе. Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п. I. Общие с другими кислотами 1. Диссоциация: R-COOH ↔ RCOO- + H+ -Сила кислот уменьшается в ряду: H-COOH > CH3-COOH > CH3-CH2-COOH ВИДЕО: Растворимостьв воде различных карбоновых кислот Карбоновыекислоты - слабые электролиты 2. Взаимодействие с активными металлами: 2R-COOH + 2Na → 2R-COONa + H2↑ ВИДЕО: Взаимодействиеуксусной кислоты с металлами 3. Взаимодействие с основными оксидами и основаниями: 2R-COOH + CaO → (R-COO)2Ca + H2O ВИДЕО: Взаимодействиеуксусной кислоты с оксидом меди (II) R-COOH + NaOH → R-COONa + H2O ВИДЕО: Взаимодействиеуксусной кислоты с раствором щелочи 4. Взаимодействие с солями слабых кислот: R-COOH + NaHCO3 → R-COONa + H2O + CO2↑ ВИДЕО: Взаимодействиеуксусной кислоты с карбонатом натрия -Соли карбоновых кислот разлагаются сильными минеральными кислотами: R-COONa + HСl → NaCl + R-COOH -В водных растворах гидролизуются: R-COONa + H2O ↔ R-COOH + NaOH ВИДЕО: 5. Образование сложных эфиров со спиртами: II. Специфические свойства 1. Образование функциональных производных R-CO-X (свойства гидроксильной группы) Получение хлорангидридов: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl 2. Образование амидов CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O Вместо карбоновых кислот чаще используют их галогенангидриды: Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами): Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп - пептидных связей 3. Реакции замещения с галогенами (свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ): 4. Особенности муравьиной кислоты H-COOH: · Даёт реакцию «Серебряного зеркала»: H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O · Окисление хлором: H-COOH + Cl2 → CO2 + 2HCl · Вступает в реакцию с гидроксидом меди(II): H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O · Разлагается при нагревании: HCOOH t,H2SO4→ CO↑ + H2O ВИДЕО: 5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов): R-COONa + NaOH t → Na2CO3 + R-H (алкан) 6. Окисление в атмосфере кислорода: R-COOH + O2 → CO2 + H2O ВИДЕО: ВИДЕО: Взаимодействие бромной воды с олеиновой кислотой Окислениемуравьиной кислоты раствором перманганата калия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
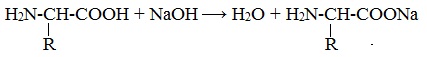
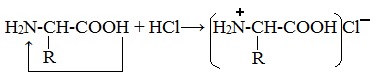
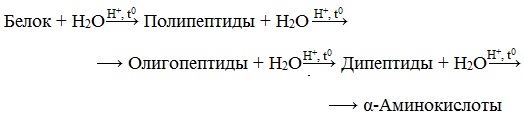


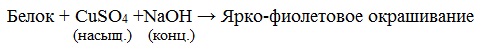
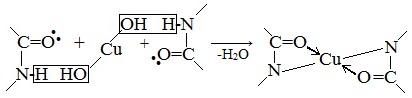

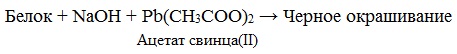









Комментариев нет:
Отправить комментарий