ПЯТНИЦА, 15.04.22 г. 401
ИНСТРУКЦИЯ ДЛЯ ТЕХ, КТО НЕ МОЖЕТ НАЙТИ СВОЮ ГРУППУ:
СПРАВА ЕСТЬ АРХИВ. В АРХИВЕ ПО-ПОРЯДКУ РАСПОЛОЖЕНЫ ДНИ НЕДЕЛИ. ТАМ ЖЕ ВИДНЫ ДАТЫ И НОМЕРА ГРУПП. ВЫБИРАЕТЕ ДЕНЬ СО СВОЕЙ ГРУППОЙ, И ОН ОТКРОЕТСЯ. УРОКИ ВЫЛОЖЕНЫ ПО РАСПИСАНИЮ. НА ОДНОЙ СТРАНИЦЕ ВЫЛОЖЕН ОДИН ДЕНЬ . ВНИМАНИЕ!!! На выполнение задания отводится 1 неделя. Моя почта : rimma.lu@gmail.com Жду ваши фотоотчеты!
Критерии оценивания: Для получения положительной оценки обучающийся должен: -соблюдать отведенное время; - разборчиво и правильно выполнить работу. Если работа будет прислана после указанного срока , оценка будет снижаться.
ГРУППА 401 ХИМИЯ 47,48
ТЕМА: Экзотермические и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения.
Экзо- и эндотермические реакции.
- Экзотермическая реакция (от экзо... вне и греч. thérmó — тепло, жар) , химическая реакция, сопровождающаяся выделением теплоты. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ. Количество выделяющейся при экзотермическая реакция теплоты зависит от массы реагентов и их природы, агрегатного состояния исходных веществ и продуктов взаимодействия, типа реакции и условий её осуществления (температуры, давления и др.) . По тепловому эффекту экзотермическая реакция противоположны эндотермическим реакциям.
- Эндотермическая реакция (от эндо... внутри и греч. thérme — тепло, жар) , химическая реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы) , восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке - это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции
Экзотермические реакции (греч. exo - вне) - химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят "+ Q" (Q - тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения. Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
N2 + O2 ⇄ 2NO - Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью "запутывания" в реакции вместо явного +Q при экзотермической реакции могут написать
ΔH <0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется - реакция экзотермическая)
Эндотермические реакции
Эндотермические реакции (греч. ἔνδον - внутри) - химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят "-Q", либо указывают точное количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 - Q
4NH3 + 5O2 = 4NO + 6H2O - Q
CaCO3 = CaO + CO2↑ - Q
С целью "запутывания" может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
-Как понять, что химическое уравнение экзотермическое или эндотермическое?
+- Берете справочник, находите стандартные энтальпии образования продуктов, складываете с учетом стехиометрических коэффициентов. Там же находите энтальпии продуктов, их тоже складываете с учетом стехиометрических коэффициентов. Находите разницу.
Если разница положительная, значит, теплота выделяется. Реакция экзотермическая. Если отрицательная - то эндотермическая.
Пример.
C + O2 = CO2
Стандартная энтальпия образования углекислого газа −393,51 кДж/моль (минус, не тире). Энтальпия образования графита и кислорода - 0.
0-393,51 < 0 , реакция экзотермическая
ТЕМА: Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Окислительно-восстановительные реакции. Степень окисления. Окислитель и восстановление. Восстановитель и окисление. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций.
Уравнения окислительно-восстановительных реакций.
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача – разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
0 | 0 | +3 –2 | ||
Al | + | O2 | = | Al2O3 |
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
`
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем "марганцовка" – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
+7 | –1 | 0 | +2 | |||||||||
KMnO4 | + | KCl | + | H2SO4 | = | Cl2 | + | MnSO4 | + | K2SO4 | + | H2O |
Составим схему электронного баланса:
Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
** Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций – окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления (когда окислитель и восстановитель – разные вещества);
2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя).
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
0 | +5 | +2 | +2 | |||||
Cu | + | HNO3 | = | Cu(NO3)2 | + | NO | + | H2O |
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс:
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”).
Остальные коэффициенты подбираются без труда по уже найденным:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в ПРОМЕЖУТОЧНОЙ степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
+3 | +5 | +2 | ||||
HNO2 | = | HNO3 | + | NO | + | H2O |
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
+3 | +3 | +5 | +2 | |||||
HNO2 | + | HNO2 | = | HNO3 | + | NO | + | H2O |
Получаем уравнение:
2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O
Или, складывая вместе моли HNO2:
3HNO2 = HNO3 + 2NO + H2O
3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
+5 | –1 | 0 | ||
KClO3 | = | KCl | + | O2 |
Это уравнение также подчиняется требованию электронного баланса:
Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO3 = 2KCl + 3O2
Теперь ясно, что перед KClO3 надо поставить коэффициент 2.
2KClO3 = 2KCl + 3O2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
Горение алюминия на воздухе.
Алюминий - активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние - алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
4Al + 3O2 = 2Al2O3
Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель.
Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей.




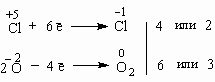

Комментариев нет:
Отправить комментарий